饶毅:辣和热——国产博士诺奖级的工作

两篇论文的作者:Erhu Cao、Maofu Liao、Yifan Cheng 和 David Julius。
(饶毅文,来源饶毅博客)辣和热在物理上完全不同,但是为什么英文问食物有多辣(spicy),可以用多热(hot)?原因是进食辣味物体时,人的口(和唇)可以同时有两种感觉:辣和热;
不过,辣味并不提高口腔(或唇)的温度。那么,为什么人同吃辣椒时会同时感到辣和热?这一司空见惯的“常识”,其原因在1997年被揭开。
旧金山加州大学(UCSF)的David Julius教授,于1980年代在Richard Axel实验室开始用当时算比较新的方法(表达克隆)寻找五羟色胺的受体。十几年后,他继续用这一方法,改为寻找辣椒素的受体,于1997年找到了一个被辣椒素激活的蛋白质分子VR1,而且发现VR1还被加热所激活,因为辣椒素已知与痛觉通路有关,所以这一工作,同时揭开了温度感受的机理和痛觉的外周感受的部分机理,其中痛觉的研究当时还需后续实验。
在进化上,辣味和热感是可分开的,鸟类用VR1分子只感受热,并不感受辣,因为鸟类与哺乳类VR1蛋白质在氨基酸序列上有差别。Julius实验室于2002年发现和证明了鸟类和哺乳类VR1差别所在。
Trp通道家族
Julius实验室于1997年找到大鼠的VR1时,发现它属于TRP通道家族。
1969年,美国印地安纳州的Purdue大学生物系教授Willam Pak等研究果蝇的视网膜电图(ERG),用以研究果蝇的视觉、并寻找影响果蝇视觉的突变种。同年,英国爱丁堡大学动物系的Cosens和Manning(1969)发现一种突变,根据ERG的变化,他们称突变果蝇为瞬间感受器电位(Trp),相应突变的基因也就是Trp基因。
1970年代后期兴起克隆基因,1980年代很多研究人员克隆基因(笔者做研究生的第一个工作也是靠克隆果蝇的基因混饭吃)。1989年,美国加州大学伯克利分校Gerald Rubin实验室的博士后Craig Montell克隆了果蝇的Trp基因。他们发现Trp基因编码的蛋白质有多重大约19个氨基酸组成的疏水段,这种一般预计为跨细胞膜区域,所以预计Trp蛋白质是跨膜蛋白质。因为它的突变影响果蝇视网膜对光反应,所以最容易推想的功能是离子通道。但证明它是离子通道花了相当长的时间。
Trp类似的基因后来发现于多种生物,包括人。但不仅果蝇的Trp本身并不感受光,其它的Trp具体起什么作用,如何起作用,也都不清楚,直到Julius实验室1997年的工作,揭示了其直接功能,从此Trp的研究热火朝天,很多人加入Trp研究的行列,发现更多Trp家族成员,发现更多功能,如对Julius实验室2002年用薄荷寻找冷敏感的分子,结果发现是Trp家族另一成员,而还有科学家发现Trp通道感受压力,等等。其中曾激动人心的可能性是听觉也用Trp通道,不过2010年美国加州的Scripps研究所的Patapoutian实验室发现Piezo才更可能是听觉用的感受压力的离子通道。
视觉、嗅觉、味觉,其第一级感受分子都是GPCR(G蛋白耦联受体),其关键是视觉研究,而最初发现感受光的蛋白质分子(视紫红质)是十九世纪的德国科学家,其全序列确定是1980年代初的美国和俄国科学家。1990年代,美国科学家沿着视网膜发现的路径,假设嗅觉的感受分子相似于视觉,从而发现了嗅觉的分子,后来味觉再模仿嗅觉也得到类似发现。其中发现嗅觉感受分子的两位科学家获得了生理诺奖,而1980年代发现视觉第一级分子的被愚钝的委员会所忽略。
Trp通道功能的确定,解决了其他常见感觉(温、压、部分的痛)第一级的分子机理,有较大意义。
解析Trp通道结构
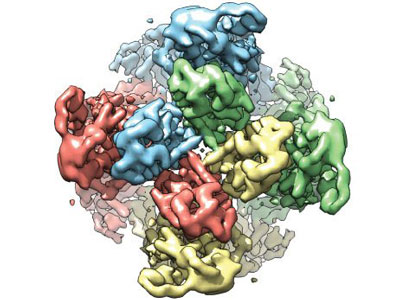
TRPV1
在公认Trp通道蛋白有多种重要作用后,其机理就为人们很想理解。
这时,结构生物学就显得很重要。结构生物学以前主要依赖X线衍射,也可用核磁共振(NMR)研究部分小分子的结构,而电子显微镜(EM)一般认为太粗,对蛋白质分子中的关键结构来说,EM的分辨率不够高。
多年来,少数一些科学家努力提高EM的分辨率,他们的工作前期进展缓慢,最近有重要突破。
2013年,好几篇文章报道科学家们用冷冻电镜 (Cryo-EM)解析蛋白质的结构。
12月5日,UCSF的程亦凡与Julius两个实验室合作,解出了TRP通道家族V1的结构,引起很大兴趣(Liao et al., 2013; Cao et al., 2013),第一作者皆华人,通讯作者为程与Julius。
如果没有结构分析,Julius可能单独获诺贝尔生理或医学奖。
现在有结构分析,而且是冷冻电镜应用成功的早期例子之一,Julius与程亦凡获诺贝尔化学奖的可能很大。
近十年来,诺贝尔化学奖不仅常给生物相关的工作,而且是每三年就有一次给结构生物学,化学奖委员会的热心对Julius和程亦凡不是坏事。
长期坚持
程亦凡为武汉大学1978级物理系本科生,在武大物理系再获硕士后于1991年获中国科学院物理所获博士。他在欧洲和美国几经周折,改为用物理学方法研究生物学问题,加入结构生物学,用过X线衍射,而用冷冻电镜创造了2013年的成就。
程亦凡到2006年才任助理教授,这时他的学术同龄人多半或是教授、或放弃学术生涯,一般人很难坚持这么久。
国产博士,学科交叉是一优势。
我国努力提高培养研究生的能力,使研究生的质量不断提高。目前的国内博士研究生,会有一批、而不是个别,做的非常好。
今后国产博士将做的更好。
2013年12月12日星期四
事由:昨天下午在北大-清华生命科学联合中心的学术讨论会上,冷冻电镜是激烈讨论的主题之一,与其只说几句,不如写下道理来。这种文章,一共只要约两小时,因为有些人是我在混饭吃时遇见过的科学家,很早知道他们的人或工作(如研究果蝇的Montell、或我在UCSF做学生时就做助理教授的Julius),而还有些内容是我在2000到2003年主讲科学院/北大/清华生物学研究生BIO2000课程的内容,基本文献可以从那时的PPT拷贝。
将口头讨论变成文字,可增加自己的记忆、可从不在场的人中再发现其他有兴趣进行intellectual exchange的学者、也可能在学生读者中对他们的科学兴趣有所裨益、还可以增加聊天的内容。
附来自生物360的报道:
在一项技术壮举中,来自加州大学旧金山分校(UCSF)的科学家们以近原子分辨率,确定了在疼痛和热知觉中起中心作用的一种蛋白质的结构。相关两篇研究论文刊登在了近期出版的《自然》(Nature)杂志上。
在 UCSF 博士后研究人员曹尔虎(Erhu Cao,音译)和廖茂福(Maofu Liao,音译)博士的领导下,这项新研究为寻找更好的新型疼痛疗法的药物设计者提供了一些新见解。此外,它也标志了结构生物学领域的一个分水岭:在此之前,人们认为新研究中所采用的低温电子显微镜(cryo-EM)技术无法这样细致地显像小蛋白。
论文的共同通讯作者、加州大学旧金山分校生物化学和生物物理学副教授、电子显微镜学家程一凡(Yifan Cheng)博士说:“其影响将是广泛的。过去从来没有人会相信,你能够利用这一方法获得这样的分辨率——这被认为是不可能的。新研究开辟了大量的机会。”
两篇《Nature》论文报道了分辨率为 3.4 埃的 TRPV1 蛋白的结构。 TRPV1 具有一些独特的特性,自 1997 年加州大学生理学系主任和教授 David Julius 博士首次发现它以来, TRPV1 引起了生物学家和公众广泛的兴趣。
TRPV1 是一种大量存在于感觉神经细胞中的离子通道:它在细胞膜中形成一个孔道,钙离子等通过这一通道,改变细胞使之产生动作电位,并将信号传递给其他神经元。
然而不同于其他的离子通道, TRPV1 可对化学物质或温度变化产生反应。例如,当存在辣椒素(capsaicin )时 TRPV1 会改变它的形状打开通道,也会对极高的温度做出响应引起疼痛。
Julius 和同事们证实了,蜘蛛毒素和植物等多种不同来源的一系列疼痛诱导毒素和炎症性化合物也可以激活 TRPV1 ,这些关联使得这一蛋白成为了药物开发者们的关注焦点。
第一篇《Nature》文章描述了 TRPV1 处于静息状态时的结构,第二篇论文则揭示了当与一种蜘蛛毒素和一种辣椒素样化合物结合时, TRPV1 通道改变形状的机制。这些显像支持了一种 TRPV1 “两阀门”激活模型:这一通道的不同部分可响应不同的化学制剂改变构象,对于希望通过精确控制 TRPV1 门控来调节疼痛反应的药物设计者们而言,这一信息很有价值。
“这有点像看到了这一通道关闭时,部分打开时,然后全部打开时的快照,这对于一种离子通道而言相当少见,” Julius 说。
程一凡说:“在此之前, TRPV1 和相似蛋白结构最好的分辨率为大约 15-20 埃,许多来自低分辨率数据的结构缺乏充分的细节提供机制信息。”
Julius 表示:“许多结构生物学家一直认为低温电子显微镜不如X射线晶体学,在最好的情况下后者能够获得低于 2 埃的分辨率。”
然而正如其名,X 射线晶体学需要将目的蛋白结晶,像 TRPV1 这样的嵌在细胞膜中的蛋白非常难做到这一点。而这些膜蛋白却是包括细胞信号传导和药物作用等重要的生物学领域中的决定性因子。
Julius 说,由于程一凡实验室取得的巨大进展,能够精确地捕获蛋白质的形状改变现成为了低温电子显微镜的一个巨大优势,他预计许多结构生物学家,甚至是那些支持X射线晶体学的人,也将会把低温电子显微镜添加到他们的工具箱中。
原文检索:
Maofu Liao, Erhu Cao, David Julius & Yifan Cheng. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature, 04 December 2013; doi:10.1038/nature12822
Erhu Cao, Maofu Liao, Yifan Cheng & David Julius. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature, 04 December 2013; doi:10.1038/nature12823

