我国科学家应用单细胞遗传分析仪和拉曼组技术为抗菌药效评价提供新方法
在国家自然科学基金项目(项目编号:91231205,31327001,31425002)等资助下,中国科学院青岛生物能源与过程研究所徐健课题组及其合作者创立了基于重水(D2O)标记单细胞拉曼成像的药物抗菌效果评价技术,实现了在单个细菌细胞精度下药物对细胞代谢活性抑制性的快速精确测量,有可能成为指导临床精准用药的新标准之一,研究成果以“Metabolic-Activity-Based Assessment of Antimicrobial Effects by D2O‑Labeled Single-Cell Raman Microspectroscopy”(基于重水标记单细胞拉曼成像的抗菌代谢活性检测)为题于2017年3月10日在线发表在Analytical Chemistry上。
论文链接:http://pubs.acs.org/doi/abs/10.1021/acs.analchem.6b05051。
单个活体细胞是生命的基本单元与进化单位。单细胞功能基因组技术能够从深度、灵敏度和通量三个维度来探索“生命体系的异质性机制”等基础生物学科学问题以及突破对“尚不可培养微生物”研究的技术瓶颈。徐健研究员课题组研制的“基于拉曼分选的单细胞遗传分选仪”已实现不需标记、基于生化表型的单细胞分选,并针对分选出的单细胞能够在微流芯片上进行集成分析,将现代组学分析手段深化与拓展到单细胞层面。
目前,在必须使用抗生素治疗的临床案例中,有30%-50%存在治疗方案制定、抗生素选择与疗程等方面的错误。细菌感染中的抗生素不当使用,一方面可能导致贻误病情,甚至造成人体菌群紊乱,诱导其它疾病发生,另一方面还会加速耐药菌的出现。因此,准确全面的抗菌效果评价技术目前是实现快速、准确、有效的抗生素用药的前提和基础。作为目前微生物药敏试验、抗菌药效评价和临床抗菌方案制定的主流标准与主要依据之一,MIC(minimum inhibitory concentration)指数(体外培养细菌24小时后能抑制培养基内病原菌生长的最低药物浓度)的测量过程费时费力,且对实验室难以培养或生长缓慢的病菌无法检测。另外,MIC仅从抑制细菌数目扩增的角度反映与测量药效,却不能检测处于“NGMA”(Non-Growing but Metabolically Active)状态(药物作用下已经不再增殖但仍然具备代谢活性)的存活细胞,导致在临床上仍然可能引起复发性感染和诱导耐药菌出现。
针对上述抗菌素药效检测的瓶颈,徐健研究员课题组应用基于拉曼分选的单细胞分析仪,开发了基于拉曼组(Ramanome)的细菌药物应激效应成像技术。徐健研究员与中山大学光华口腔医院合作,以导致龋齿的变形链球菌(Streptococcus mutants)与多种临床常用抗菌药物为模式,研究单细胞拉曼成像精确测量细胞利用胞外重水(D2O)分子的速率,而后者与该细胞的代谢活跃程度呈高度的正相关。该方法从对微生物代谢活性抑制的角度定量测量药效,能发现处于“NGMA”状态的细胞。同时,由于与重水标记耦合的拉曼成像具备单个细菌细胞的检测精度,对于大部分细菌、古细菌和真菌,实现了测量同一样品内不同细胞之间在药物抗菌消炎上的差异程度。另外,该方法能够在30分钟内快速区分氟耐受型和氟易感型的变形链球菌,药效检测与评价的速度显著提高。
基于上述单细胞成像分选与功能分析技术,徐健研究员及其合作者提出了“基于代谢活性的最低抑菌浓度”(MIC-MA指数)的抗菌药效指标:药物作用8个小时后所有细胞代谢活性全部并且彻底被抑制的最低药物剂量。他们发现,对于特定的病菌和特定的抗菌药物,MIC-MA指数与MIC指数有显著的不同,如在高达60倍MIC的氨苄西林剂量时,仍然存在高比例的“NGMA”状态变形链球菌细胞,有可能发生抗生素压力消失时链球菌复发感染。与目前临床普遍参照的MIC指数相比,MIC-MA指数有重要特色与优势。
更重要的是,传统的MIC检测是将受试微生物作为同质化的群体,而忽视了针对细胞之间药效一致性的考察与评价,而MIC-MA在单个细胞精度的药敏性与药效检测,在考察耐药性形成和细菌微进化的机制等生命科学基础研究方面具有重要意义。
相关技术与方法已申请国家专利四项。
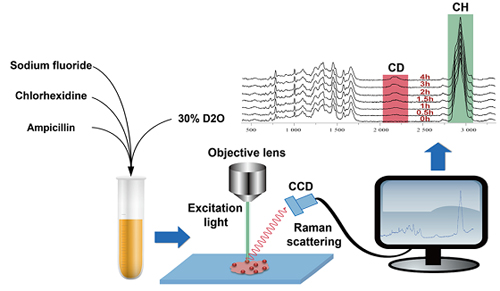
图. 基于重水标记单细胞拉曼成像的抗菌代谢活性检测方法

