美国新发现蛋白Sprouty-2是导致T细胞在HIV感染中功能缺失罪魁祸首
美国约翰霍普金斯大学医学院发现一种名为Sprouty-2的蛋白能够使攻击HIV的免疫细胞功能缺失。这为HIV患者带来新希望,因为通过抑制这个蛋白,有助于恢复免疫细胞抗击HIV的能力。相关文发表于2013年12月02日的《Journal of Clinical Investigation》杂志上。
美国新发现蛋白Sprouty-2是导致t细胞在HIV感染中功能缺失罪魁祸首
T细胞,是白血细胞的一种,被安排来识别和杀死感染特定病毒或其它致病剂的细胞。一个T细胞要有效地这样做,需要其执行多种功能——理所当然的是,细胞会抗击新的感染。但是,当感染拖延了,像HIV一样,T细胞经常就变的“耗竭”,丧失两个或更多的功能,除了所谓的“精英抑制器”——极少数HIV感染患者其T细胞从来不会耗竭。
为了调查“耗竭”的原因,Johns Hopkins团队首先找到一种方法,在实验室中重现这种现象。Schneck实验室的研究生Yen-Ling Chiu,通过生长的抗流感T细胞和定剂量的大量抗原(一类分子,就像在公牛面前挥动的一面红旗,发信号给免疫细胞进行抗击)给药,模拟了长期慢性感染的效果。这样做“使得T细胞功能失调——它们看起来像HIV中耗竭的T细胞,”Chiu说。
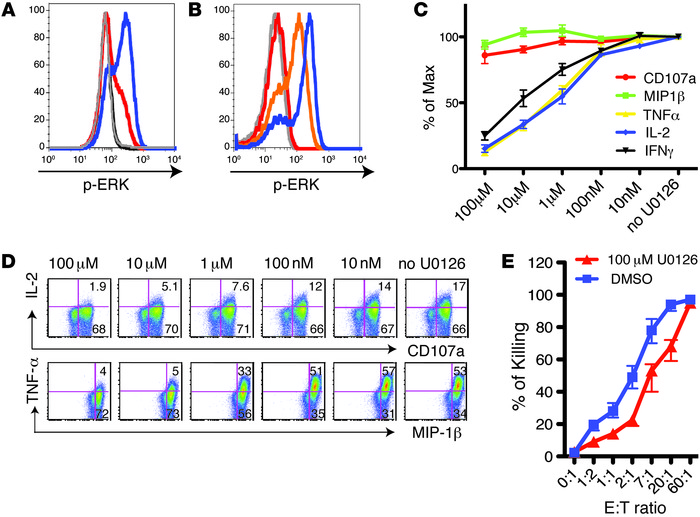
接下来,Chiu寻找在功能失调细胞和新鲜T细胞内分别制造的蛋白之间的差异。他说,事实证明,在两组细胞中存在数量差异的许多蛋白,参与了一连串称为MAPK/ERK通路的生物化学事件。这些通路控制各种各样的重要过程,例如细胞分裂。
与新鲜T细胞相比,一种蛋白——Sprouty-2在耗竭的T细胞中更加丰富,其他研究已经证明,这种蛋白能减慢MAPK/ERK通路。Chiu推测Sprouty-2可能是T细胞耗竭的罪魁祸首,他利用一种特别设计的病毒,在一些T细胞中抑制Sprouty-2基因,发现这些细胞比有Sprouty-2的细胞更容易保留它们的功能。
Schneck说:“我们很惊喜地发现,t细胞耗竭由这样一种中枢通路控制,特别的是,它以这样一种高度有规则的方式工作,保持一些T细胞的功能,而不是其它的。”
尽管这个发现非常的有趣,Schneck说:“真正的考验是,它是否也躲藏在HIV患者的血液样本中。”在一项实验中,研究者发现,在耗竭的抗HIV T细胞中,降低Sprouty-2的数量,会部分地恢复这些细胞的功能。其他研究团队已经表明,降低称为PD-1的其它蛋白的数量,适当地提高了耗竭T细胞的功能,借鉴这些研究结果,研究团队下一步将尝试在抗HIV细胞内抑制Sprouty-2和 PD-1蛋白。Schneck说:“这能完全逆转细胞的耗竭。”
传染病医学分部的副教授Joel Blankson也参与了部分研究工作,他说:“通过鉴定Sprouty-2和相关蛋白作为潜在的靶点,这些结果支持这一想法——有一天,免疫疗法也许会为HIV-1感染带来一种功能性的疗法。”
目前,还没有已知的化合物能阻止活体动物中的Sprouty-2,因此,Schneck团队计划正在进行迈向基于这项研究成果的新药开发的第一步。Schneck指出,他们也将调查Sprouty蛋白是否也能引起抗击其它慢性感染的T细胞的耗竭,例如结核病和丙型肝炎。
原文摘要:
Sprouty-2 regulates HIV-specific T cell polyfunctionality
Yen-Ling Chiu, Liang Shan, Hailiang Huang, Carl Haupt, Catherine Bessell, David H. Canaday, Hao Zhang, Ya-Chi Ho, Jonathan D. Powell, Mathias Oelke, Joseph B. Margolick, Joel N. Blankson, Diane E. Griffin, Jonathan P. Schneck
The ability of individual T cells to perform multiple effector functions is crucial for protective immunity against viruses and cancer. This polyfunctionality is frequently lost during chronic infections; however, the molecular mechanisms driving T cell polyfunctionality are poorly understood. We found that human T cells stimulated by a high concentration of antigen lacked polyfunctionality and expressed a transcription profile similar to that of exhausted T cells. One specific pathway implicated by the transcription profile in control of T cell polyfunctionality was the MAPK/ERK pathway. This pathway was altered in response to different antigen concentrations, and polyfunctionality correlated with upregulation of phosphorylated ERK. T cells that were stimulated with a high concentration of antigen upregulated sprouty-2 (SPRY2), a negative regulator of the MAPK/ERK pathway. The clinical relevance of SPRY2 was confirmed by examining SPRY2 expression in HIV-specific T cells, where high levels of SPRY2 were seen in HIV-specific T cells and inhibition of SPRY2 expression enhanced the HIV-specific polyfunctional response independently of the PD-1 pathway. Our findings indicate that increased SPRY2 expression during chronic viral infection reduces T cell polyfunctionality and identify SPRY2 as a potential target for immunotherapy.

