PLoS Pathogens:中科院微生物所钱韦研究组发现植物病原细菌有“智
2016年12月31日,国际微生物学知名期刊《PLOS Pathogens》在线发表了中国科学院微生物所钱韦研究组题为“Two-Component Signaling System VgrRS Directly Senses Extracytoplasmic and Intracellular Iron to Control Bacterial Adaptation under Iron Depleted Stress”的研究论文,论文报道了植物病原细菌能感知并统筹控制细胞铁平衡。微生物所助理研究员王莉博士是该论文的第一作者,钱韦研究员为论文通讯作者。
铁是一种金属,也是一切细胞生物生存所必需的一种物质。“缺铁”就必须“补铁”,这是大家早已通过广告熟悉的道理。然而凡事过犹不及,铁对于生物而言也是一把“双刃剑”:缺铁固然不妙,但如果细胞内铁离子浓度过高,反而会激发活性氧和超氧化物对细胞的损伤,具有较强的毒害作用。因此,生物进化出了感知铁浓度高低的精密机制,用于调节细胞内的铁平衡。
虽说铁是地壳中总含量排名第四的丰富元素,但对于病原细菌而言,当其侵入到动、植物寄主体内时,却经常会面临事关生死的缺铁环境:原来寄主为了控制感染蔓延,会通过产生小分子化合物、载铁蛋白等多种方式,螯合体内的铁并将其“藏”起来,造成铁极度匮乏的环境,从而抑制病原微生物生长和繁殖。比如说,患有慢性感染的病人往往并发缺铁性贫血,就是由于铁被超量螯合后,不但病原微生物会缺铁而生长缓慢,同时人体自身也无法获得足够多的铁,使得血红素含量下降所致。因此,病原细菌为了攫取足量的铁,一方面必须将寄主体内的铁“争抢”到手并运输进入细菌细胞内,以供生存所需。另一方面,当“抢”到的铁积累得足够多时,又必须尽快停止上述过程,避免 “铁吃撑了”而对自身产生毒害作用。那么,一个有趣的科学问题是:细菌是一类“简单的”单细胞生物,既无神经系统又不掌握现代化学分析技术,它们如何感知细胞内外铁浓度的高低,正确应对,从而在与寄主免疫系统残酷的生存斗争中取得压倒性优势?
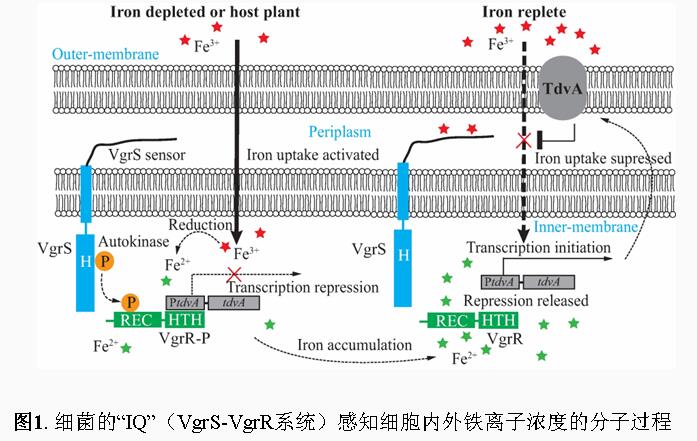
钱韦研究组发现,在十字花科蔬菜黑腐病的病原-野油菜黄单胞菌中,一个称为VgrS-VgrR的分子系统承担着探测细胞内、外铁离子浓度的核心功能。VgrS-VgrR属于细菌的双组分信号转导系统,此类系统在细菌中扮演着类似人类“智商(IQ)”的生物学功能,能够感知外界环境刺激并控制细胞产生适应反应。其中,VgrS是一个位于细菌细胞膜上,发挥外界信号探测功能的受体组氨酸激酶。当细菌生存于铁离子匮乏的环境中时,会激活VgrS的激酶活性,并将细胞内的VgrR蛋白磷酸化。被磷酸化后的VgrR蛋白能够控制数十个转运铁元素相关基因的表达,从寄主体中“争抢”宝贵的铁资源。有趣的是,在这个过程里,VgrR必须严格抑制一个细菌外膜通道蛋白(TdvA)的表达,否则这个“任性”的自身通道蛋白会严重干扰细菌对铁的吸收过程,关闭其表达才能使细菌正常感染植物。
然而,当病原细菌从寄主植物或环境中“吃进”过多的铁,铁离子浓度积累到可能产生毒害作用时,细胞内过多的二价铁离子又会特异地结合到VgrR蛋白上,阻止其继续调控铁吸收相关基因的表达,同时解除对TdvA蛋白编码基因表达的抑制,驱使细菌停止吸收铁离子。因此,这项研究发现:野油菜黄单胞菌在适应铁匮乏环境时具有精细的“供给侧”统筹协调能力:首先,它能利用VgrS感知细胞外铁匮乏环境,启动对铁离子的吸收,其次,在铁含量过高时它又能利用VgrR感知细胞内高浓度的铁,停止泵入更多的铁。在VgrS-VgrR双组分信号转导系统的管控下,野油菜黄单胞菌得以审慎地利用寄主植物体内的铁元素,成功完成感染。
由于VgrS-VgrR是黄单胞菌感染植物寄主过程中的保守信号系统之一,如果能够人工干扰它们的作用就能够抑制细菌的正常感染过程,因此,VgrS-VgrR系统也将成为未来发展新型抗菌新策略,防控植物病原细菌的理想分子靶标之一。
原文链接:
Two-Component Signaling System VgrRS Directly Senses Extracytoplasmic and IntraCellular Iron to Control Bacterial Adaptation under Iron Depleted Stress
原文摘要:
Both iron starvation and excess are detrimental to cellular life, especially for animal and plant pathogens since they always live in iron-limited environments produced by host immune responses. However, how organisms sense and respond to iron is incompletely understood. Herein, we reveal that in the phytopathogenic bacterium Xanthomonas campestris pv.campestris, VgrS (also named ColS) is a membrane-bound receptor histidine kinase that senses extracytoplasmic iron limitation in the periplasm, while its cognate response regulator, VgrR, detects intracellular iron excess. Under iron-depleted conditions, dissociation of Fe3+from the periplasmic sensor region of VgrS activates the VgrS autophosphorylation and subsequent phosphotransfer to VgrR (ColR), an OmpR-family transcription factor that regulates bacterial responses to take up iron. VgrR-VgrS regulon and the consensus DNA binding motif of the transcription factor VgrR were dissected by comparative proteomic and ChIP-seq analyses, which revealed that in reacting to iron-depleted environments, VgrR directly or indirectly controls the expressions of hundreds of genes that are involved in various physiological cascades, especially those associated with iron-uptake. Among them, we demonstrated that the phosphorylated VgrR tightly represses the transcription of a special TonB-dependent receptor gene, tdvA. This regulation is a critical prerequisite for efficient iron uptake and bacterial virulence since activation of tdvA transcription is detrimental to these processes. When the intracellular iron accumulates, the VgrR-Fe2+ interaction dissociates not only the binding between VgrR and the tdvA promoter, but also the interaction between VgrR and VgrS. This relieves the repression in tdvA transcription to impede continuous iron uptake and avoids possible toxic effects of excessive iron accumulation. Our results revealed a signaling system that directly senses both extracytoplasmic and intracellular iron to modulate bacterial iron homeostasis.
doi:10.1371/journal.ppat.1006133
作者:钱韦

