生化与细胞所科研人员发现PKM2抑制细胞凋亡的新机制
2016年12月30日,国际学术期刊Cell Research在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所杨巍维研究组的最新研究成果“Mitochondrial PKM2 regulates oxidative stress-induced apoptosis by stabilizing Bcl2”。该研究揭示了细胞存在氧化压力时,PKM2通过稳定Bcl2从而抑制细胞凋亡的新机制。
PKM2(Pyruvate kinase M2 isoform)是糖酵解途径的关键酶,在肿瘤细胞的发生发展中起重要作用;除了其代谢活性以外,现已有多个实验室报道了其蛋白激酶活性。杨巍维研究员的前期研究发现在EGFR激活的条件下,PKM2可转运至细胞核,磷酸化组蛋白H3,通过表观遗传的方式调控一系列原癌基因的表达(Nature 2011,Cell 2012)。除了在细胞增殖中发挥作用,最近有报道称PKM2在肿瘤细胞的抗凋亡过程中也发挥着作用,但其作用机制尚不清楚。
杨巍维组的最新研究表明,在氧化应激的条件下,胞浆中的PKM2可与伴侣蛋白HSP90相互作用,并发生构象变化;结构改变的PKM2转移至线粒体上,与Bcl2相互作用并磷酸化Bcl2第69位苏氨酸;该磷酸化可阻止Bcl2与Cul3泛素连接酶的结合,并稳定Bcl2蛋白水平,进而抑制氧化应激导致的细胞凋亡;细胞及动物实验验证了PKM2介导的Bcl2磷酸化在胶质瘤的发生、发展中起重要作用;临床样本的分析也进一步提示Bcl2磷酸化水平与胶质瘤病人分级和预后有着密切的关系。
杨巍维组副研究员梁冀、博士研究生曹锐修为该论文的共同第一作者。该项研究工作得到了中组部、国家科技部及国家基金委的资助。该研究数据收集工作得到生化与细胞所公共技术服务中心分子平台、细胞平台、动物平台的支持。
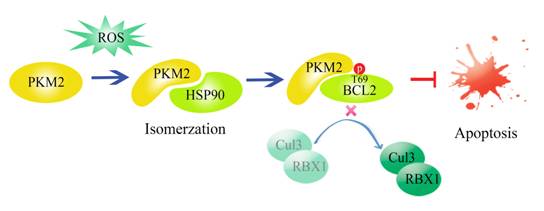
肿瘤细胞中,氧化压力刺激PKM2在HSP90的帮助下发生异构化,同时转移到线粒体上,通过磷酸化Bcl2的第69位苏氨酸,阻断Cul3-RBX1与Bcl2的结合,从而稳定了Bcl2的蛋白水平,抑制细胞凋亡。
相关附件
