Angew Chem Int Ed:中国科技大学龙冬研究组发表癌基因蛋白Ras构象动
近日,《Angew.Chem.Int.Ed》杂志上发表了中国科学技术大学生命科学学院及合肥微尺度物质科学国家实验室龙冬教授课题组题为“Microsecond Timescale Dynamics of GDP-Bound Ras Underlies the Formation of Novel Inhibitor-Binding Pockets”的研究论文,研究人员运用液体核磁共振技术在癌基因蛋白Ras的构象动态研究进展,揭示了新型抑制剂分子在Ras蛋白上作用位点形成的动态机理。博士研究生毛媛媛为论文第一作者,龙冬教授为论文通讯作者。
Ras蛋白是细胞内一类重要的信号转导分子,控制着一系列涉及细胞生长、分化、凋亡的相关基因。病理条件下,Ras蛋白的突变和约20%的人类恶性肿瘤有关,因此成为抗癌药物研发的一个重要靶标。近年来,通过片段筛选所获得的一些小分子抑制剂可与GDP结合状态下的Ras蛋白特异性结合,并有效抑制Ras的致瘤性信号转导活性。然而早前研究表明,非结合态(Apo form)的Ras蛋白表面光滑,并无明显可被小分子利用的结合位点,抑制剂小分子在Ras蛋白上结合口袋的形成机理尚不清楚。
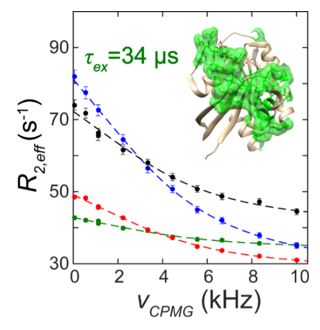
本研究中,龙冬课题组运用多种前沿核磁共振弛豫实验方法探测了Ras蛋白在不同时间尺度的构象动态性质,并定量捕捉到发生在微秒时间尺度的一项局部运动过程(交换相关时间为34微秒)。该研究工作所测定的构象动态区域与Ras上的多种共价性和非共价性抑制剂分子作用口袋分布高度相关,揭示了Ras与小分子抑制剂的特异性识别源自蛋白质在微秒时间尺度的内在运动性质,并支持了广义构象选择理论。 Ras蛋白在微秒时间尺度的动态性质先后在野生型和致癌性突变体中得到证实。这项工作为针对Ras蛋白的进一步抗癌药物研发提供了理论基础。
原文链接:
Microsecond Timescale Dynamics of gdp-Bound Ras Underlies the Formation of Novel Inhibitor-Binding Pockets
原文摘要:
The recent discovery of inhibitory compounds binding to distinct pockets on GDP-bound Ras has renewed the view on the druggability of this crucial cancer driver. However, the origin of these pockets, which are not readily formed in the crystal structure in the absence of the compounds, is yet unclear. Herein, we explored the intrinsic flexibility of Ras⋅GDP on microsecond to millisecond timescales using relaxation-based NMR experiments, and identified substantial slow dynamics withτex of 34 μs at 5 °C, which maps to the regions showing a high level of correlation with those displaying conformational differences between the inhibitor-bound and free states. These findings, which have been demonstrated in both wild-type Ras and the oncogenic mutant (G12V), support the mechanism of extended conformational selection for Ras–inhibitor interactions where the small molecules redistribute the protein conformational ensemble favoring the final bound states.
作者:龙冬

