谢旗组在植物激素ABA受体稳定性调控机制的研究取得重要进展
发表日期:2016-11-22 11:54AM 阅览次数:
泛素化修饰在植物的生长发育及抵抗外界不良环境中起着非常重要的作用。泛素化过程是由泛素激活酶 (E1)、泛素结合酶 (E2) 和泛素连接酶 (E3) 介导的级联催化反应,最终将泛素加到底物蛋白上,从而影响底物蛋白的稳定性、活性或者细胞定位等。泛素化被证明在植物激素受体的稳定性调控中起决定作用。其中26S蛋白酶体依赖的泛素化途径参与调节植物逆境激素ABA受体稳定性,例如,两类多亚基的E3连接酶复合体CUL1s和CUL4s及单亚基的E3连接酶RSL1分别介导PYR/PYLs/RCARs类ABA受体蛋白的泛素化修饰,促进ABA受体进入26S蛋白酶体途径进行降解。目前关于泛素化修饰调控ABA信号途径的研究主要集中在E3泛素连接酶及其底物鉴定方面,而关于与E3连接酶共同起作用的E2和E2-like在ABA信号中的调控机制知之甚少。
中国科学院遗传与发育生物学研究所谢旗研究组通过对一个E2-like蛋白VPS23A的研究发现,VPS23A是ESCRTs (Endosome Sorting Complex Required for Transports) 的一个关键组分,vps23a突变体表现出ABA超敏感的表型。ESCRTs在蛋白分选进入MVB内部囊泡方面发挥功能。在动物中,内膜系统的蛋白分选在调节受体蛋白的定位和稳定性方面发挥着重要作用。通过研究VPS23A如何调控ABA信号通路,发现VPS23A既识别非泛素化ABA受体又识别其K63位连接的泛素分子链,能够介导ABA受体进入膜运输途径,从而进入液泡进行降解从而影响ABA受体的定位和蛋白稳定性。该研究揭示了ABA受体通过非26S蛋白酶体进行降解的新途径,为研究植物激素的信号途径提供了新的理论指导。上述研究结果于2016年11月14日在线发表在Mol. Plant杂志 (DOI: 10.1016/j.molp.2016.11.002)。 谢旗研究组的博士研究生于菲菲为该论文第一作者。研究得到了科技部蛋白质重大专项以及自然科学基金委项目资助。
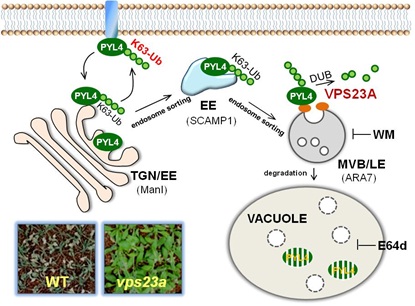
图1 VPS23A通过内膜系统降解途径调节ABA受体稳定性的工作模型

