中国科学家发现NgAgo系统有效 为“基因功能敲除”而非
发表日期:2016-11-16 12:05PM 阅览次数:
图片摘自原文
最近,由中国科学院主办的英文期刊Cell Research(细胞研究)在线发表了复旦大学和南通大学联合研究的一篇题为“NgAgo-based fabp11a gene knockdown causes eye developmental defects in zebrafish”(基于NgAgo技术对fabp11a基因敲减可引起斑马鱼眼睛发育缺陷)的 “致编辑信”文章。
文章中,研究者介绍,在使用NgAgo之后,虽然发现了NgAgo的其它特性,但并没有发现任何基因编辑的现象。研究者利用NgAgo技术在斑马鱼的细胞中进行研究后发现,斑马鱼的眼睛发育出现了缺陷,随后通过测序后他们发现,从基因组层面上来讲,使用NgAgo技术并未对斑马鱼产生任何基因编辑的效应,仅仅只是mRNA的表达量上发生了改变。
这项研究中,研究者并非利用哺乳动物进行研究,而是利用模式动物斑马鱼进行了相关研究,斑马鱼是一种具有多种优势的模式生物,其能够帮助科学家们进行遗传学、发育生物学、血管生物学及疾病模型等领域的研究;在过去很多年里,诸如锌指核酸酶(zinc-finger nucleases,ZFNs )、转录激活因子样效应物核酸酶(TALENs)、以及CRISPR/Cas9都已经在斑马鱼中进行了研究,而近来一种名为gDNA/NgAgo的新系统也因其脱靶率较低易操作等独特的优势让很多科学家眼前一亮,这项研究中,来自复旦大学和南通大学的研究人员就通过研究调查了是否gDNA/NgAgo系统能够用来操控斑马鱼机体的基因,随后研究者就以fabp11a基因作为研究对象进行深入研究。
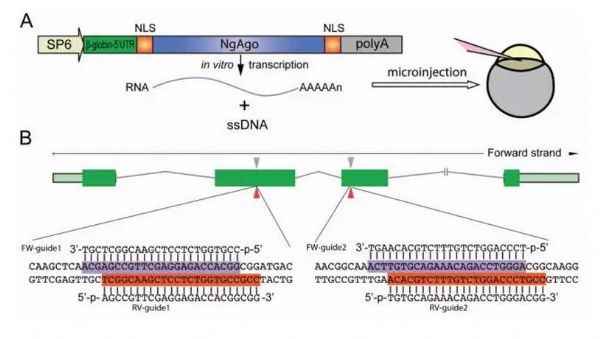
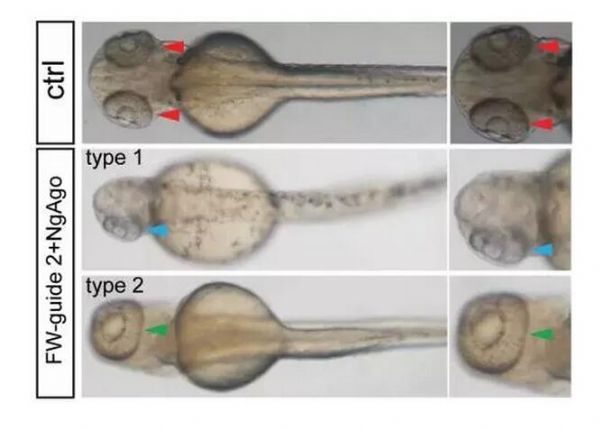
脂肪酸结合蛋白11a(fabp11a)是细胞内FABPs结合蛋白家族成员之一,该蛋白家族在调节机体葡萄糖和脂质动态平衡及炎症上扮演着重要作用,截至目前为止,研究者并不清楚基因fabp11a在斑马鱼发育过程中的具体功能,为了调查是否5’-磷酸化单链DNA能够指导NgAgo来干扰斑马鱼机体内源性基因的表达,研究者构建了氨基端和羧基端分别携带核定位信号肽的NgAgo分子(NgAgo-2nls)来用作对斑马鱼进行深入研究,研究者发现,两个具有24bp长的5’-磷酸化单链DNA寡核苷酸(FW-guide 1和FW-guide 2)能够靶向作用fabp11a基因的第二个和第三个外显子,而且每一个寡核苷酸都能够同NgAgo-2nls的mRNA共同注入到斑马鱼的胚胎细胞中,更有意思的是,研究者还发现,大约30%被注入的斑马鱼胚胎都会表现出严重的眼部表型,要么一只眼睛小一只眼睛正常(第一种类型);要么头顶长出一只较大面积融合性的眼睛(第二种类型)。
为了调查是否斑马鱼眼睛缺陷的发生是由fabp11a基因的遗传突变引起的,研究者从异常眼部表型的斑马鱼胚胎中进行全基因组DNA的提取,并且利用PCR的方法对靶向区域序列进行扩增,研究者发现,异常的斑马鱼胚胎机体中fabp11a基因的表达水平降低了,而且gDNA/NgAgo系统引发的斑马鱼胚胎异常表现或许能够通过外源性添加fabp11a的mRNA来恢复。
图片摘自原文
研究者为了证实gDNA/NgAgo系统的确能够作为一种基本原则来敲除斑马鱼机体中的基因,研究者利用该系统检测了斑马鱼机体中另外一种名为ta的基因,该基因能够编码斑马鱼胚胎中胚层形成所需的T-盒转录因子;随后研究人员对斑马鱼机体中kdrl,lama1以及flt1基因都进行了检测,结果表明gDNA/NgAgo系统能够明显降低这些基因的表达并且诱发与斑马鱼出现眼睛发育缺陷结果相似的一些表型。
这项研究中,研究者通过研究发现,利用gDNA/NgAgo系统进行的基因敲减能够影响斑马鱼机体中基因的功能表达,此外研究者在斑马鱼所有胚胎中并未检测到任何基因突变,为此研究者假设,gDNA/NgAgo或许能够同靶向基因结合来阻断基因的转录,总而言之,研究者认为gDNA/NgAgo系统或许能够提供另外一种特殊的系统来对斑马鱼进行基因敲减研究。
最后研究者指出,此前韩春雨的研究论文是在哺乳动物(人)的细胞中进行的相关研究,而这篇研究中我们是在斑马鱼中进行的研究,二者属于两个不同的系统,而且在做法上也存在一定的差别,在使用NgAgo技术之后,虽然我们发现了NgAgo的其它特性,但并未发现任何基因编辑的现象。当研究人员在斑马鱼的细胞中使用NgAgo技术后发现,斑马鱼的眼睛发育出现了缺陷,当然这疑似发生了基因编辑现象。但是通过后期测序后他们发现,这从基因组层面上来讲没有出现任何基因编辑的现象,只是mRNA表达量上发生了改变,这或许就说明,引起斑马鱼胚胎发育缺陷的原因是基因敲减,而并不是基因编辑。
论文链接:www.nature.com/cr/journal/vaop/ncurrent/full/cr2016134a.html

