王大元:中美两国批准转基因程序的差异
发表日期:2016-11-09 12:01PM 阅览次数:
提要:我担心中国目前的处境有可能完不成“十三五”计划的要求。借鉴美国完成一个转基因产品商业化的程序,或许可以改进我们的工作效率。
国务院“十三五”规划中提出:“将加大转基因棉花、玉米、大豆研发力度,推进新型抗虫棉、抗虫玉米、抗除草剂大豆等重大农产品产业化。”也就是说到2020年要完成上述作物的产业化。从目前的情况来看,难度很大,不在政策上和思想上(我这里说的“思想”包括科学家和农业部官员的思想认识)做重大调整,有可能完不成任务。美国是全球转基因产品的老大,我在这里从审批程序来介绍一下美国的情况,同时也将中国的程序与美国的程序做了一些比较,提出了我的看法和建议。
美国GMO监管法律和监管单位
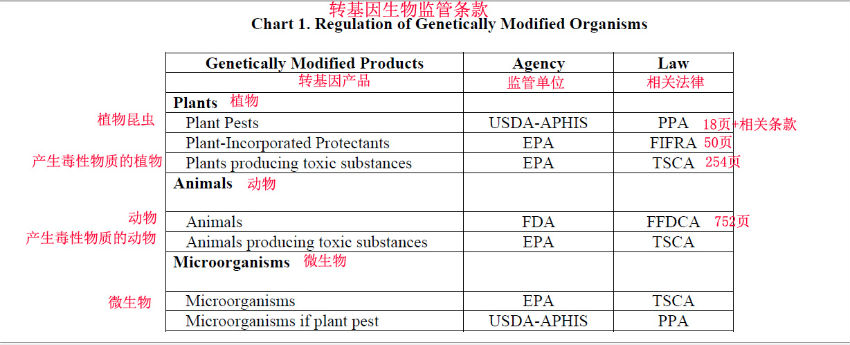
转基因植物产品(GMO products,包括作物,食品和饲料)商业化由美国农业部动植物卫生检验局(APHIS)监管审批,转基因动物产品由FDA监管审批(例如三文鱼)。有关法规在上面表格的右列列出。我这里尽力从上千页的资料中,整理出简要介绍美国转基因植物审批程序的大致情况,并与中国和欧盟的审批程序做一比较。
美国批准一个转基因作物栽种,食用和饲料的最后批准权力机构美国农业部(USDA),这个批准称之为“Deregulation”(解除对转基因产品的监管)。具体来说是由美国农业部的APHIS管控。拿到美国农业部APHIS的“Deregulation”(解除对转基因作物的监管)的批文后,就不再受转基因安全法规监控,可以随意种植,作为食品或饲料销售,完全是一个商业行为了。
美欧中三地转基因产品审批程序的比较:

由上图可以看出中美欧对转基因产品取得安全证书的审批程序基本是一致的,主要的不同是美欧取得安全证书后就Deregulation(不受转基因产品安全法律监管),可以与所有的非转基因产品一样自由商业化;但欧盟大多数国家现在行政指令依然不许栽种(Ban)。
中国没有禁止(Ban)栽种转基因作物的行政法规,但中国取得安全证书后不取消监管,要求按照种子法做区域化实验。问题是中国长达7年时间不允许已经拿到安全证书的转基因作物产品进入区域化实验,也不给出一个不允许进入区域化实验的公开理由,因此中国拿到转基因产品安全证书后,戛然而止,7年不能往下走(这就是我上图所画的不让你产业化的一根红杠杆的大山,让你无法翻越)。另一个奇怪的事是,中国进口占全世界大豆总产量约50%的转基因大豆作为食品和饲料,但没有经过区域化的比较。
我的看法是,这是在转基因领域内落后的生产关系严重束缚了先进生产力发展的典型事例。
具体介绍美国转基因植物产品商业化审批的过程:
其程序大致是:
1.种子公司做出大量基础工作;
2.相关公司(申请人)向美国农业部申请批准放行做转基因作物的田间试验,每一个田间试验需要USDA批准放行,称之为环境释放的田间试验;
3.美国农业部的APHIS发放环境释放许可证:美国农业部的APHIS审查了有关公司的申请做转基因作物田间试验的报告后,认为公司自己做的初步试验符合条件,就会发给允许做环境释放的田间试验的批准书。
4.申请解除监管:在上述田间释放后,如果各种性状/安全性都达到APHIS的要求,做实验的公司就要向APHIS申请可以商业化的批准文件:“Deregulation”(解除监管)。在Deregulation前的所有试验材料都是被美国政府制定的生物技术安全法规管控着的,即都是regulated article(监管材料。一旦被批准 Deregulation (解除监管),就与一般的品种一视同仁处理,可自由出售种子,可自由用于杂交育种做亲本。
上述内容可简化为下面的示意图:

美国申请田间释放和解除监管过程与中国的一些差异:
每一个申请Permit 和Deregulation的申请报告至少300多页,我不可能在此作详细介绍,每个申请报告的目录可以看出所需要做的实验的内容。需要时我可以提供。
美国审批时间与中国的差异:
美国:美国农业部全年任何时间都可以接受申请田间释放要求的报告,在收到申请田间释放实验的报告后,30天内要给出初步审查意见的回复,120天内要给出是否批准环境释放的决定(即授予Permit).
中国:现在一年只审批一次,多久时间给答复无规定。
批准环境释放的数量差异:
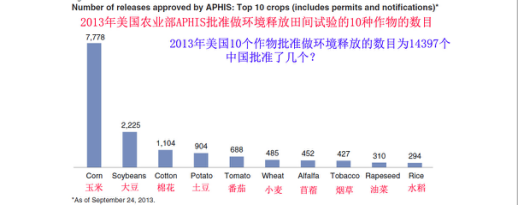
美国:2013年有10种作物申请环境释放田间试验批准,获得批准做环境释放田间试验的总数目是14397个。
中国:未找到确切数字。
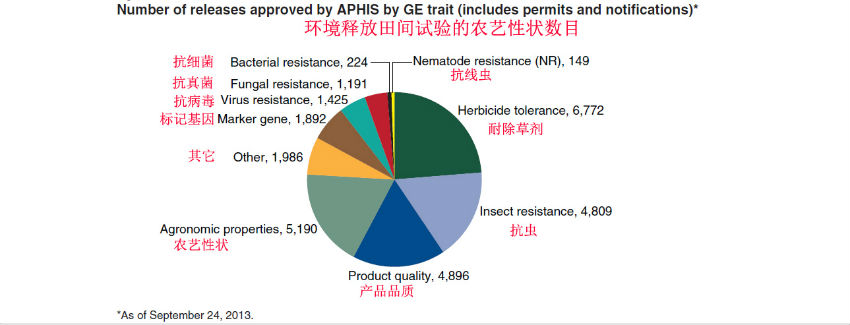
批准环境释放的农艺性状差异:
美国获得批准环境释放田间试验作物的农艺性状分布为:
中国主要是做抗虫耐除草剂及少量抗逆的试验。
批准实验的地点差异:
美国:所有州的任何地点都可以做环境释放田间试验,只要符合监管的安全条件。 这实际上就把中国的区域化实验的要求包括进去了。
中国:根据农业部上周颁发的文件《农业部关于进一步加强转基因作物安全监管工作的通知》(农科教发〔2016〕3号),只能在海南省南部的三亚市、陵水县、乐东县做转基因作物试验制种实验。而且黑龙江省、甘肃张掖地区可以违反中央政令,不许种植转基因作物试验材料。这种差距差异的原因我本人搞不懂。
实验点差异:
美国:美国的开发者,可以向USDA申请一个转基因事件(一个作物的一个性状)的实验,同时在不同自然条件(气候、地理位置、土壤条件)的多个州开展环境释放田间实验。这样就兼顾了区域化实验的一些要求。
中国:中国情况本人不清楚。
申请环境释放和解除监管的报告差异:
美国:美国环境释放田间试验的申请报告和解除监管的申请报告可以有2份,一份只注有“删去商业机密”的保密资料”(CBI Deleted)字样的报告,只提供部分数据给公众,另一份是寄给农业部审查的全文报告。
这是Mon80100带有“CBI Deleted”的样页:

——这就是中国农业部不能把孟山都的申请报告全文公布的主要原因。
题外话:
“十三五”规划中关于转基因作物产业化有具体指标:要让转基因玉米等在2020年实现产业化。我介绍美国完成一个转基因产品商业化(Deregulation)的程序的目的,就是借鉴它们的经验来改进我们的工作效率。我的担心是我们中国目前的处境有可能完不成“十三五”计划的要求。
我这里提一个建议:优先开发美国专利保护过期的转基因玉米和转基因大豆。 抓住专利保护期已过的美国转基因玉米和大豆,简化审批程序,有可能完成“十三五”计划中关于转基因玉米和大豆产业化的要求。
具体来讲就是开发Mon810为基础的转基因玉米和Round-up转基因大豆。前者的基因Cry1Ab的专利期在2014年已经过期了(见孟山都2014年的年报),没有知识产权的保护,任何人都可以开发;而其安全性已经有了21年的人畜食用无一例事故的可靠保证,全世界(包括欧盟)都有进口做食品和饲料安全资料;其栽种面积在所有转基因玉米中占据第一位,其抗虫性非常高;我国农民已经体会到这种玉米抗虫性的优越性,之前查处的所谓“非法”种植的转基因玉米基本都是Cry1Ab系列;大北农等公司已经用Cry1Ab转到中国有关玉米中获得一系列的优良转化事件;据了解目前国内自己开发的转基因玉米的抗虫性能都没有明显超过Mon810系列。所以从安全性、效能、经济性来考虑,开发它是应该首先考虑的。
对中国农业部的官员和这个行业的科学家来说,我认为他们这里有一个认识误区:一定要先开发自己创新的转基因玉米。如果有当然好,但是目前没有明显超过Mon810系列的我们自己的转基因玉米(国内的专家的说法是不比Mon810差)。如果我们现在开发的有自主知识产权的转基因玉米明显超过Mon810的话,早就冲到国际市场上去了(人家早来跟你谈合作了)。而且对于这种全新的转基因玉米的安全试验,要做的试验项目太多,花的时间较长,花钱也多。
所以我建议把Mon810系列的Cry1Ab作为当前重点攻关的材料,同时农业部转基因安全委员会要尽快配合制定一个快速通关的条规。
我现在简要介绍一下中国开发专利期已过的国外化学合成药的程序。现在中国药物市场上的西药,接近100%是仿制药(多数专利已经过期),国家在新药研发上投资的钱比转基因产品要多几倍,没有我们自己开发的一类新药。这一点在中国药物研发的科学家和行政官员都已经有了深刻的认识。所以开发国外专利已经过期的药物是CFDA(中国食品药品管理局)和中国科学家目前的一个重点。
在专利期要过期之前的2年,有关药厂已经根据CFDA的要求,在做这种仿制药的临床前和I期临床试验了。
对于自己开发的有知识产权保护的1类新药的审查程序比较复杂,CFDA的要求比较严格。但对于仿制药的实验要求就大大简化了。如何简化,我下面简单介绍一下,原则是药学上证明仿制药与原来药的等效性。
临床前实验的要求,只要用一种动物做一个月的试验,证明仿制药的药效与原药等效性就可以了,等效性的指标是药效在原药的80%-125%之间,不需做其它的毒理试验和长毒试验,就可以进入I期临床。I期临床试验需要至少24对人做试验(仿制药24人,原药24人作对照), 药效达到原药的80%-125%,即认为是等效,马上就可以进入后面的临床试验。II期和III期试验可以合并一起来做。
上面我举的是仿制药的例子,实际上中国目前各个领域内,基本上都是采用仿制别人专利已经过期的产品来开发,然后再开发自己有知识产权的产品。
农业部及转基因作物安全委员会是否可以参照中国仿制药的审批法规,简化专利已经过期的转基因玉米产业化的审批手续?我们农业部和中国这个领域的科学家,一直高调表示要优先发展具有自己知识产权的转基因产品,这种做法值得商榷。

