陈鹏课题组发展“比较蛋白质组学“新技术
陈鹏课题组发展“比较蛋白质组学“新技术
2016年9月日,生命科学联合中心陈鹏课题组在《美国科学院院刊》(PNAS)上发表题为“Comparative proteomics reveal distinct chaperone-client interactions in supporting bacterial acid resistance”的论文(doi: 10.1073/pnas.1606360113),利用新开发的“比较蛋白质组学“技术,揭示了大肠杆菌抵抗酸刺激的新机制。
肠道病原微生物独特的抗酸机制使得它们能够顺利通过人体胃液的强酸环境,进而在肠道造成感染,严重的甚至可能导致死亡。HdeA 和HdeB是目前在这些病原微生物膜间质内发现的唯一的一套抗酸伴侣系统,在许多肠道菌中都高度保守。因此,研究它们抵御强酸环境的机制将有助于我们更好地理解这些致病菌与宿主之间的作用关系。另外,HdeA 和HdeB是典型的条件无序分子伴侣蛋白,利用无序结构与多种不同的底物蛋白质相互作用以发挥功能,对它们的研究也能帮助我们更好的理解蛋白质无序结构与功能之间的关系。北大化学院陈鹏课题组一直致力于抗酸伴侣蛋白底物的捕捉与研究。在之前的工作中,他们与北大生命科学院昌增益课题组合作,开发了一种遗传编码的蛋白质光交联探针DiZPK,并以大肠杆菌为模型,成功地捕获并鉴定了HdeA的底物蛋白,揭示了细菌在抵御酸胁迫过程中独特的分子伴侣协作机制(Nat Chem Biol 7(10):671–677.)。
在新发表的工作钟,为了进一步揭示这两个看似冗余的分子伴侣HdeA和HdeB是如何相互合作,并在保护大量不同底物蛋白的同时,又避免了非特异性的结合,陈鹏课题组将新一代的可切割型光交联探针DiZSeK与荧光差异双向凝胶电泳(2D-DIGE)相结合,发展了一种名为CAPP-DIGE的“比较蛋白质组学“的策略而对HdeA与HdeB的整个底物蛋白组进了直接的比较和质谱鉴定。结果表明,HdeA与HdeB在活细胞条件下对底物蛋白表现出明显的差异。进一步的研究,发现这种差异性来源于二者对酸刺激的不同响应,使得HdeA和HdeB分别保护了对酸刺激耐受性不同的底物蛋白组。在酸回复过程中,他们进一步发现底物在被分子伴侣释放时也是受pH调控的,且这种pH 调控的底物释放过程保证了底物在酸回复过程中的有效重折叠。综合以上研究结果,他们提出了细菌抵御酸胁迫过程中pH 对分子伴侣的底物特异性的调控机制,即pH通过系统性地调控HdeA 、HdeB以及底物蛋白的折叠状态和功能,让分子伴侣蛋白在不同条件下逐步激活、协同分工保护不同的客户蛋白,同时保证了底物蛋白在被释放后有效地进行重折叠。这一模型为细菌抵抗酸刺激提供了一种高效、经济、灵活和协调的蛋白质质量控制策略。该调控机制很可能也适用于其他的条件无序分子伴侣系统,而这一新开发的CAPP-DIGE技术对于利用蛋白质组学鉴定和比较动态条件下的蛋白-蛋白相互作用及其变化都有着广阔的应用前景。
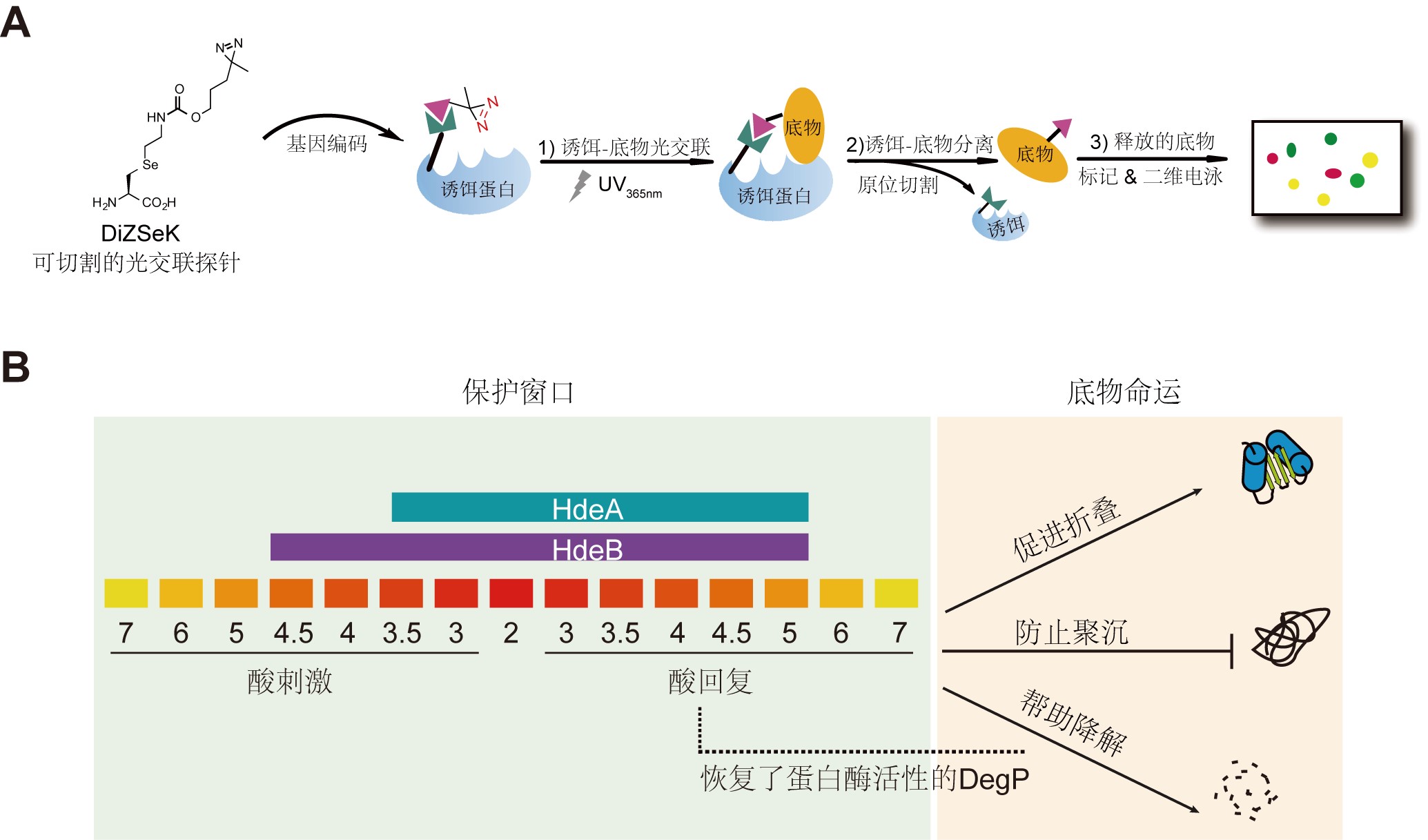
图1 (A) CAPP-DIGE流程示意图;(B) HdeA与HdeB协同抗酸的新机制
北京大学化学学院博士研究生张帅与何丹为该论文的共同第一作者。该工作得到了国家自然科学基金、科技部、教育部、生命科学联合中心的资助。
原文链接http://www.pnas.org/content/early/2016/09/09/1606360113


