Nature Methods:中国科学家发表基因编辑新成果,只“剪”单个碱基
发表日期:2016-10-18 08:56AM 阅览次数:
近期,河北科技大学副教授韩春雨提出的基因编辑系统NgAgo因多名研究人员表示无法重复备受质疑。事实上,在NgAgo之后,国内高校/机构在开发基因编辑新工具方面连续取得了新进展。上个月,南京大学的研究小组在Genome Biology杂志上发表了一项突破性成果,开发了不再受到靶序列限制的结构导向性DNA编辑新技术(详情)。
10月10日,发表在Nature Methods上题为“Targeted AID-mediated mutagenesis (TAM) enables efficient genomic diversification in mammalian cells”的一项研究中,来自中国科学院上海生命科学研究院/上海交通大学医学院健康科学研究所的常兴研究组又开发出了一种编辑DNA碱基的新方法。

常兴博士(图片来源:健康科学研究所官网)
据健康科学研究所官网报道介绍,单核苷酸的多样性是遗传多样性的主要来源,是分子进化的动力和很多疾病的直接诱因。然而由于哺乳动物基因组的高度稳定性,在哺乳动物细胞内很难高效和高通量地诱导单核苷酸的突变,进而研究这些突变的功能。虽然通过CRISPR等基因编辑技术,可以实现较高效的DNA切割和基因敲除,但现有的CRISPR技术对于体内构建单核苷酸突变仍处于低效阶段。
有别于绝大多数体细胞基因组,适应性免疫系统在淋巴细胞发育过程中可以进行高效编辑,对抗原受体进行高效突变,产生近乎无限的抗原受体库,用以抵御可能的病原体入侵。受这一机制的启发,研究小组发现诱导抗体高频突变的胞嘧啶核苷脱氨酶(activation-induced cytidine deaminase,AID)与失活的dCas9融合后,实现了功能变异的高通量筛选。在sgRNAs的引导下,dCas9-AID-P182X (AIDx)可直接将胞嘧啶或鸟嘌呤转变为其它三种碱基,在预期位点产生一系列的变异。
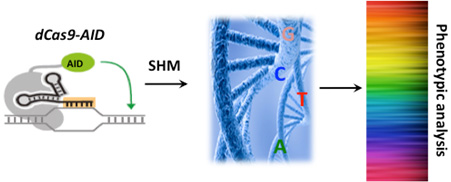
dCas9-AID融合蛋白,被sgRNA招募到相应的基因组DNA上,随机诱导胞嘧啶和鸟嘌呤的点突变,从而实现体内特定DNA序列的多样化,通过遗传筛选,高通量分析单核苷酸突变的功能。(图片来源:健康科学研究所官网)
在尿嘧啶DNA糖基化酶抑制剂的帮助下,dCas9-AIDx可以诱导胞嘧啶特定地向胸腺嘧啶转变,创造特异性的点突变,实现单碱基的精确编辑。此外,在慢性粒细胞白血病细胞中,利用dCas9-AIDx靶向BCR-ABL,研究小组有效地鉴定出了与伊马替尼(imatinib)耐药相关的已知突变和新突变。科学家们认为,靶向性AID介导的核苷酸突变(targeted AID-mediated mutagenesis,TAM)为在碱基水平筛选功能获得性变异提供了遗传工具。
Nature、Science曾率先发表2篇同类成果
一直跟踪基因编辑技术的小编发现,Nature和Science曾分别在今年4月和8月发表过类似的技术。4月20日,哈佛大学化学生物学教授David Liu带领的研究小组利用来自大鼠的脱氨酶率先在Nature上发表了能够有效改变给定基因中单个DNA碱基的基因编辑系统。
不久后,发表在Science上的一项研究中,日本神户大学的Akihiko Kondo教授带领的科学家小组通过将一种被修饰过的Cas9酶与来源于七鳃鳗(sea lamprey)免疫系统中AID结合,也找到了编辑单一DNA核苷酸的新方法。
哈佛大学的遗传学大牛George Church表示,这些脱氨酶解决了大部分先前已有的基因编辑方法(包括TALENSs、ZFN和Cas9)存在的最大问题,即真正所需的 “基因编辑”会与通过非同源性末端接合机制产生的随机插入和删除存在竞争。此外,这种基于脱氨酶的系统还降低了双键切割带来的毒性。
开发这种工具临床应用的一个关键问题是,进一步检查突变脱靶效应。另一个需要考虑的问题是,如何特异性的靶向目标序列中的单个碱基,而不影响邻近的碱基。
常兴研究员简介:
1997-2001:北京大学生物生命科学学院,生物学士;2001-2006:美国俄亥俄州立大学,病理系,免疫学博士;2007-2012:美国耶鲁大学免疫学系博士后(Postdoctoral Research Associate);2012- 中国科学院上海生命科学院/上海交通大学医学院健康科学研究所组长;
目前研究重点为:1)T细胞亚群分化的信号转导机制;2)RNA及RBP调控T细胞功能的机理;3)免疫耐受的细胞与分子机制;
2011年入选中组部第一批“青年千人计划”。
文章参考资料:
健康所常兴课题组报道DNA碱基编辑的新方法
Nature Methods:Targeted AID-mediated mutagenesis (TAM) enables efficient genomic diversification in mammalian cells

