Cell:美国新证实α-突触核蛋白突变加上农药接触会致死多巴胺神
美国麻省理工学院等机构的研究人员构建包含α-突触核蛋白突变的人类诱导多能干细胞(hiPSCs),发现这类细胞在接触农药时会导致线粒体信号通路MEF2C-PGC1alpha遭到自由基攻击,从而导致多巴胺神经元死亡。同时,他们鉴定出一种分子异恶唑可保护突变型神经元免于测试农药诱导的细胞死亡。相关文章发表于2013年11月27日的《Cell》杂志上。
美国新证实α-突触核蛋白突变加上农药接触会致死多巴胺神经元
多巴胺是一种向控制运动和协调的大脑区域发送信息的神经递质。直到现在,研究人员还主要是基于动物研究,以及流行病学研究证实农民、农村人口和其他接触农用化学品的人们疾首次病风险增高,来确定农药和帕金森病之间存在联系。
首次采用患者细胞研究
研究人员在新研究中,利用了α-突触核蛋白(alpha-synuclein)编码基因存在突变的帕金森病患者的皮肤细胞。α-突触核蛋白是构成帕金森病病理标志:路易小体(Lewy body)主要蛋白质。
利用患者的皮肤细胞,研究人员构建出了包含这种突变的人类诱导多能干细胞(hiPSCs),随后在一些细胞中“矫正”了这一α-突触核蛋白突变。接下来,他们将所有这些细胞进行重编程,使之成为帕金森病中损伤的一种特异神经细胞类型:A9多巴胺能神经元,鉴别了除α-突触核蛋白突变之外的各个方面。
结果表明
“在正常和突变型神经元接触到百枯草、代森锰和鱼藤酮等农药后,具有突变的细胞内生成了过量自由基,造成多巴胺能神经元损伤,导致了细胞死亡,”研究的共同作者、Jaenisch实验室研究员Frank Soldner说。
论文的主要作者、Del E. Webb中心研究人员Scott Ryan博士说:“事实上,我们观察到短期接触低于EPA接受水平剂量的这些农药,所造成的有害效应。”
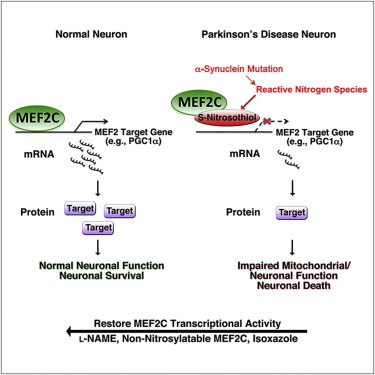
拥有除单一突变之外、遗传上相匹配的神经元,使得阐明遗传对于农药诱导的神经元死亡的贡献变得简单。在这项研究中,研究人员能够精确地描绘出具有这一突变的细胞在接触农药时,破坏了一个重要的线粒体信号通路:MEF2C-PGC1alpha——通常这一信号通路起保护多巴胺神经元的作用。自由基攻击MEF2C蛋白,导致了这一保护神经细胞免受农药损伤的信号通路功能丧失。
Lipton 说:“在我们了解这些农药改变了这一信号通路和这些分子之后,我们利用高通量筛查确定了能够抑制自由基对这一信号通路产生影响的分子:异恶唑 (Isoxazole),它可以保护突变型神经元免于测试农药诱导的细胞死亡。由于几种FDA批准的药物中都包含有异恶唑衍生物,我们的研究发现或许对于重新利用这些药物来治疗帕金森病具有潜在的临床意义。”
尽管研究清楚地表明了突变、环境以及多巴胺神经元损伤之间的关系,但它并没有排除其他的突变和信号通路也同样重要。研究小组计划进一步探究能够说明基因和环境相互作用促成了帕金森病,以及阿尔茨海默氏症和肌萎缩侧索硬化症等其他神经退行性疾病的另外一些分子机制。
作者简介:
麻省理工学院生物学教授Rudolf Jaenisch博士,Sanford-Burnham医学研究所Del E. Webb神经科学、衰老和干细胞研究中心主任及教授Stuart Lipton以及研究助理教授Rajesh Ambasudhan是这项研究的共同资深作者。Jaenisch是干细胞研究领域的权威人物,他是Whitehead研究所的创始人之一,曾经担任过国际干细胞学会的主席。其在一系列的领域做出了有影响的工作,包括基因敲除小鼠、表观遗传学研究、核移植、iPSC等,解决了这些领域几乎所有的重要问题。
原文摘要:
Isogenic Human iPSC Parkinson’s Model Shows Nitrosative Stress-Induced Dysfunction in MEF2-PGC1α Transcription
Scott D. Ryan,Nima Dolatabadi,Shing Fai Chan,Xiaofei Zhang,Mohd Waseem Akhtar,James Parker,Frank Soldner,Carmen R. Sunico,Saumya Nagar,Maria Talantova,Brian Lee,Kevin Lopez,Anthony Nutter,Bing Shan,Elena Molokanova,Yaoyang Zhang,Xuemei Han,Tomohiro Nakamura,Eliezer Masliah,John R. Yates,Nobuki Nakanishi,Aleksander Y. Andreyev,Shu-ichi Okamoto,Rudolf Jaenisch,Rajesh Ambasudhan,Stuart A. Lipton
Parkinson’s disease (PD) is characterized by loss of A9 dopaminergic (DA) neurons in the substantia nigra pars compacta (SNpc). An association has been reported between PD and exposure to mitochondrial toxins, including environmental pesticides paraquat, maneb, and rotenone. Here, using a robust, patient-derived stem cell model of PD allowing comparison of A53T α-synuclein (α-syn) mutant cells and isogenic mutation-corrected controls, we identify mitochondrial toxin-induced perturbations in A53T α-syn A9 DA neurons (hNs). We report a pathway whereby basal and toxin-induced nitrosative/oxidative stress results in S-nitrosylation of transcription factor MEF2C in A53T hNs compared to corrected controls. This redox reaction inhibits the MEF2C-PGC1α transcriptional network, contributing to mitochondrial dysfunction and apoptotic cell death. Our data provide mechanistic insight into gene-environmental interaction (GxE) in the pathogenesis of PD. Furthermore, using small-molecule high-throughput screening, we identify the MEF2C-PGC1α pathway as a therapeutic target to combat PD.

