生命中心杨茂君研究组在《自然》发表论文首次报道了线粒体呼吸链超级复合物...
生命中心杨茂君研究组在《自然》发表论文首次报道了线粒体呼吸链超级复合物结构
9月21日,生命中心杨茂君研究组在《自然》(Nature)期刊发表题为《哺乳动物呼吸体结构》(The architecture of the mammalian respirasome)的研究长文(Article)(1),首次报道了迄今为止分辨率最高的线粒体呼吸链超级复合物—呼吸体的冷冻电镜三维结构。该论文是杨茂君教授研究组继2012年首次在《自然》杂志报道了II-型线粒体呼吸链复合物I之后,在该领域的又一重要研究进展(2)。这一目前为止世界上所解析的最大也是最复杂的膜蛋白超级复合物结构为我们深入理解哺乳动物呼吸链复合物的组织形式、分子机理以及治疗细胞呼吸相关的疾病提供了重要的结构基础。
呼吸作用是生物体最基础的生命活动之一。人类呼吸体结构异常会导致多种疾病,比如阿尔兹海默综合症、帕金森综合症、多发性硬化、少年脊髓型共济失调以及肌萎缩性脊髓侧索硬化症等。呼吸体蛋白分布于线粒体内膜上,是执行呼吸作用的超大分子机器。1977年,美国科学家Hackenbrock CR提出细胞呼吸是由线粒体内膜上的四个呼吸链蛋白复合物分步完成的,这四种蛋白复合物分别为复合物I(CI,NADH脱氢酶)、复合物II(CII,琥珀酸脱氢酶)、复合物III(CIII,细胞色素c还原酶)和复合物IV(CIV,细胞色素c氧化酶),所有这些复合物都是由众多蛋白亚基和多个电子传递辅基组成的,并且在结构和功能上都是独立的。2000年,科学家们发现这些复合物并不是完全独立存在的,而是相互结合形成更高级的组织形式——呼吸链超级复合物。后续的研究发现,单独的呼吸链复合物之间通过不同的组合方式相互结合,可以形成多种类型的超级复合物,其中具有完整呼吸活性的超级复合物又被称作呼吸体。哺乳动物中丰度最高、最为重要的呼吸体是由1个CI,1个CIII的二聚体和1个CIV组成的,即I1III2IV1。
哺乳动物呼吸体I1III2IV1是由81个蛋白亚基(70种不同蛋白分子)所构成的分子量高达1.7兆道尔顿的膜蛋白超级复合物。各复合物之间的结合相对比较松散,所以呼吸体并不适合利用晶体学的手段进行研究,却非常适于应用冷冻电镜进行结构解析。在本论文中,杨茂君研究组不断优化样品的纯化方法,通过筛选、添加北京清博汇能医药科技有限公司为本课题在蛋白纯化及活性检测过程中无偿提供的大量活性小分子化合物,最终拿到了结构稳定、均一性好的呼吸体超级复合物。同时实验结果也验证了这一系列小分子化合物对呼吸体超级复合物的特异调节作用,为进一步的药物开发奠定了良好的基础。在生命科学联合中心和清华大学结构生物学高精尖创新中心的大力支持下,杨茂君研究组获得了高质量的冷冻电镜数据,并利用单颗粒三维重构的方法最终获得了整体5.4埃的近原子分辨率结构,其中复合物I和复合物III的分辨率达到3.97埃(图a)。在论文的审稿过程中,两篇分辨率分别为4.2埃和3.9埃的哺乳动物线粒体呼吸链复合物I的结构文章先后投稿到《自然》杂志并迅速发表(3, 4)。这些针对单个复合物I的研究也从侧面证明了研究组所解析的结构的正确性。
在近60多年的研究中,线粒体呼吸链复合物中每一个单独的呼吸链复合物都对应着多个理论来描述它们传递电子以及转运质子的分子机制。由于缺少呼吸体的结构信息,各呼吸链复合物之间电子是如何传递在此之前并不清楚。杨茂君研究组发现,在CI与CIII的跨膜区有一个缝隙,很可能是辅酶Q储存和流动的场所,辅酶Q被限制在这一区域会极大地提高CI与CIII之间电子传递的效率。CIV与CI之间没有直接的电子传递载体的交流,而CIV和CIII中结合细胞色素c的位点都位于线粒体膜间隙且在同一平面上且之间的距离非常接近,这样的结构特点会促进CIII与CIV之间细胞色素c的交流。另外,由于这些呼吸链复合物自身都是非常庞大的分子机器,尤其是CI更是由45个蛋白亚基组成的,它们如何保持自身结构的稳定是一个非常重要的问题,许多疾病都是由于这些复合物的结构异常引起的,形成超级复合物是否能够起到稳定整体结构的作用在此之前也没有定论。研究组在结构中指出,CI与CIII之间的相互作用非常紧密。在跨膜区内,CI中的蛋白亚基NDUFA11可以与CIII中的蛋白亚基UQCRB和UQCRQ发生相互作用。同时,CI中的NDUFB4和NDUFB9亚基还与CIII中的UQCRC1直接相互作用,进一步加强CI与CIII之间的联系。CIV与CI和CIII之间的相互作用则相对较弱,CIV中的蛋白亚基COX7C与CI中的ND5相互作用,而CIV中的COX7A与CIII中的UQCRC1和UQCR11有相互作用。这些蛋白亚基之间的相互作用可以使呼吸体的整体结构更加稳定,也为稳定CI的结构做出了贡献。最后,呼吸链复合物在单独存在和以结合成呼吸体形式存在的情况下构象是否相同,功能机理是否会发生变化,在此之前也不能确定。在解析的结构中,呼吸体中的CI与自由状态的CI相比,前者的跨膜臂中部区域没有发生变化,两边则弯曲向中部靠近呈弧形。这样的变化使得CI与CIII、CIV之间的相互作用更加稳定(图a-b)。
杨茂君研究组的生命学院五年级直博生谷金科、生命学院CLS项目三年级博士生吴萌以及二年级研究生郭润域同学为本文共同第一作者;清华大学高宁研究组的生命学院博士生闫凯歌在毕业前也参与该课题的部分研究工作;冷冻电镜平台主管雷建林研究员为数据收集处理提供了建议和帮助;李雪明研究员、博士生杨帆和黎艳为我们提供了宝贵的建议。杨茂君和高宁为本文共同通讯作者。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台的支持。本工作获得清华大学结构生物学高精尖创新中心、国家蛋白质科学研究(北京)设施清华基地、清华-北大生命科学联合中心、清华大学自主科研计划、清华大学蛋白质科学教育部重点实验室、科技部重大科学研究计划专项、国家自然科学基金委和北京清博汇能医药科技有限公司的大力支持。
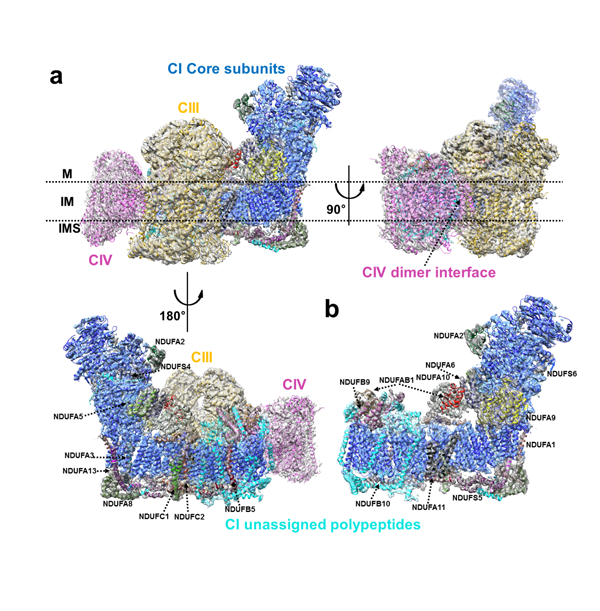
图注:a,不同侧面呼吸体结构模型及密度。b,复合物I结构模型及密度。
论文链接:
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature19359.html
相关论文:
1. J. Gu et al., The architecture of the mammalian respirasome. Nature, (2016).
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature19359.html
2. Y. Feng et al., Structural insight into the type-II mitochondrial NADH dehydrogenases. Nature 491, 478-482 (2012).
http://www.nature.com/nature/journal/v491/n7424/full/nature11541.html
3. J. Zhu, K. R. Vinothkumar, J. Hirst, Structure of mammalian respiratory complex I. Nature 536, 354-358 (2016).
http://www.nature.com/nature/journal/v536/n7616/full/nature19095.html
4. K. Fiedorczuk et al., Atomic structure of the entire mammalian mitochondrial complex I. Nature, (2016).
http://www.nature.com/nature/journal/vaap/ncurrent/full/nature19794.html


