生命中心颉伟研究组发表论文,首次揭示组蛋白修饰的代间遗传和重编程的模式...
生命中心颉伟研究组和清华大学医学院那洁研究组合作在《自然》发表论文,颉伟研究组在《分子细胞》杂志发表论文,首次揭示组蛋白修饰的代间遗传和重编程的模式和分子机理
2016年9月15日,生命中心颉伟研究组和清华大学医学院那洁研究组在《自然》杂志(Nature)上发表了题为《哺乳动物早期发育中组蛋白修饰H3K4me3的亲本特异重编程》(Allelic reprogramming of the histone modification H3K4me3 in early mammalian development)的研究论文。随后,颉伟研究组9月16日在《分子细胞》杂志(Molecular Cell)发表研究论文《组蛋白修饰重编程重塑表观记忆》(Resetting Epigenetic Memory by Reprogramming of Histone Modifications in Mammals)。两篇论文首次报道了哺乳动物组蛋白修饰从如何从亲代传递到子代的,以及早期胚胎发育中组蛋白修饰遗传和重编程的模式和分子机制。
组蛋白修饰是表观遗传信息的重要载体和生命活动的重要调控因子。然而,由于实验手段的限制,组蛋白修饰是否能够从亲代传递到子代,以及如何传递是表观遗传学领域长久以来悬而未决的问题。清华大学颉伟组通过优化传统染色质免疫共沉淀(ChIP)技术,结合新型的建库技术(TELP),开发出了一套适用于极低细胞量的染色质免疫共沉淀-建库技术(STAR ChIP-seq),并成功将其应用在小鼠早期胚胎中组蛋白修饰研究,揭示了组蛋白修饰在受精前后遗传和重编程的模式和分子调控机制。
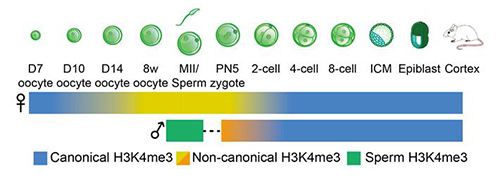
图 1H3K4me3从配子到子代的重编程过程
在《自然》论文中,研究人员主要报道了STAR ChIP-seq技术的开发以及利用STAR ChIP-seq研究组蛋白修饰H3K4me3从亲代到子代的遗传模式。研究者发现,在受精卵中,父本基因组上已经很难检测到明显的H3K4me3富集信号,提示精子来源的绝大部分H3K4me3可能已被擦除。在两细胞晚期阶段合子基因组激活之后,父本基因组重新建立了新的H3K4me3信号。与之相对的是,卵子中的H3K4me3在受精后被暂时保留了下来并一直持续到合子基因组激活之前。令人惊奇的是,研究人员意外发现在成熟的卵细胞中H3K4me3展现出了一种完全不同于以往任何一种细胞中的富集模式(non-canonical H3K4me3, or ncH3K4me3)。ncH3K4me3以一种broad的形式出现,除了启动子区域还出现在大量的非启动子区包括基因间区(intergenic region) 。与经典H3K4me3不同,ncH3K4me3富集在CpG含量较低区域。在卵细胞中,ncH3K4me3特异性地占据了DNA甲基化偏低的区域。在二细胞晚期合子基因组激活之后,ncH3K4me3 被迅速擦除,并且这种擦除是主动的而不依赖于细胞分裂的被动稀释。与此同时,胚胎重新建立了经典的H3K4me3信号。最后,由于ncH3K4me3正好出现在基因组沉默的发育时期,研究人员进一步探索了ncH3K4me3对基因组沉默的可能调控功能。通过在卵子中过表达H3K4me3的去甲基化酶KDM5B来去除H3K4me3,研究人员发现与基因激活相关的经典H3K4me3相反,ncH3K4me3可能对卵子的基因组沉默是必需的。
在《分子细胞》 的工作中,研究人员研究了另外一种重要的组蛋白修饰H3K27me3。H3K27me3及其酶复合体Polycomb complex是细胞分化以及不同命运细胞中重要的表观遗传记忆分子,通常出现在发育相关基因的启动子区。研究人员发现与H3K4me3类似,精子上的H3K27me3受精后被全基因组范围内擦除。令人惊讶的是,卵子中的H3K27me3则是有选择性的被保留在了受精卵中。其中,在发育相关基因的启动子区域的H3K27me3被特意擦除,而非启动子区的H3K27me3则被保留了下来。这些发育相关基因的启动子区直到植入后胚胎中才重新建立H3K27me3,成为经典模式。这些研究表明启动子区的H3K27me3作为一种表观遗传记忆分子在受精后被从父母双方基因组上擦除,并一直到晚期(植入后胚胎)才开始重新建立表观遗传标记。这些结果呈现出一种与H3K4me3不完全相同的遗传和重编程模式。综上所述,以上两个研究工作首次阐述了组蛋白修饰是如何从亲代传递到子代的,并且证明早期胚胎具有非常独特的表观调控机制和模式。
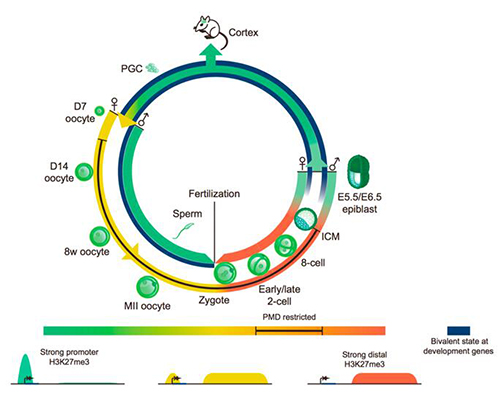
图 2H3K27me3在小鼠早期胚胎发育过程中的动态调控图谱
《自然》论文,颉伟和那洁为共同通讯作者。清华大学生命学院直博生张冰洁、生命学院CLS项目博士生郑辉、北京大学前沿交叉学科研究院CLS项目博士生黄波和清华大学医学院直博生李文治为共同第一作者。合作实验室包括新加坡科技研究局、新加坡临床科学研究院的徐丰组、同济大学高绍荣组、清华大学孟安明组和纪家葵组。《分子细胞》论文,颉伟为通讯作者,清华大学生命学院CLS项目博士生郑辉、北京大学前沿交叉学科研究院CLS项目博士生黄波和清华大学生命学院直博生张冰洁为论文共同第一作者。合作实验室包括新加坡科技研究局、新加坡临床科学研究院的徐丰组。课题得到了清华大学实验动物中心、生物医学测试中心基因测序平台、生物计算平台的大力协助和支持。该研究获得了国家重点基础研究发展计划(973计划)、国家自然科学基金委优秀青年基金、中组部青年千人计划基金以及生命科学联合中心的经费支持。
论文链接:
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature19361.html
http://www.cell.com/molecular-cell/fulltext/S1097-2765(16)30479-8


