清华大学生命学院高冠军课题组发现大量基因组“暗物质”的功能性证据
传统研究认为,人类所有的生命活动是由约2~3万个蛋白质编码基因所支配(约占2%人类基因组)。而超过95%的人类基因组并不编码蛋白质基因,而是构成了生命“暗物质”——非编码RNA。这些数目庞大的非编码RNA由于既不编码蛋白质,又缺乏生物学功能的遗传学证据,一直被很多科学家认为是真核生物基因组进化中“垃圾”信息。
2016年9月1日,清华大学生命科学学院高冠军实验室在国际著名期刊《Genome Research》正式刊发题为《长非编码RNA在果蝇精子发生中的重要作用》(Critical roles of long noncoding RNAs in Drosophila spermatogenesis)的研究论文(Research Article)。该课题组将优化后的CRISPR技术运用于长链非编码RNA(lncRNA)活体功能研究领域,以基因组强净化的遗传学鼻祖模式生物——果蝇为代表,通过高通量遗传动物模型的建立,系统阐述了lncRNA在精子发生过程中的重要作用,为揭示“暗物质lncRNA”具有重要生物学功能提供了大量的遗传学证据。
本世纪初,伴随高通量测序技术发展,构成真核生物基因组中的大量“暗物质”——lncRNA被鉴定出来,且在睾丸和脑组织中呈现高度特异性表达,暗示lncRNA的功能机制在精子发生与神经调控两个基础生命学过程具有代表性。该研究小组选择基因强净化的模式生物果蝇,系统性鉴定了128个睾丸几乎所有特异性表达的lncRNA。并运用优化后的CRISPR技术建立了105个lncRNA基因敲除突变体。通过对突变体雄性果蝇育性测试、精子发生、发育、活力及核形态等进行观察分析,发现近1/3的lncRNA基因的缺失会导致精子发育异常甚至完全不育。部分测试的lncRNAs敲除果蝇均可通过易位转基因得以完全或部分修复,表明这些lncRNAs主要以反式(trans)发挥作用。基因表达谱显示,大部分功能性lncRNAs在精子发生中调控全局基因的表达。进化分析表明,与编码基因相比,lncRNAs演化更快,且具有更大功能重要性的lncRNAs具有较高的序列保守性,暗示它们处于不断的进化选择之下。另外,与蛋白编码基因的开关调控作用不同,lncRNA可能多通过微调(fine-tune)的方式调控全局基因表达,精心策划雄性生殖细胞分化发育。总之,该研究弥补了大量功能性lncRNA在动物活体水平所缺乏遗传学证据的空白,开启了lncRNA所传递的生命信息研究的大门。
清华大学生命科学学院高冠军研究员为本文的通讯作者;清华大学生命学院2011级PTN博士生文可佳,2013级博士生杨丽娟和生命学院博士后熊团林为本文的共同第一作者。清华大学生命科学学院张强锋研究员和鲁志研究员合作参与了该课题。该研究得到了国家自然科学基金委员会和清华-北大生命科学联合中心的经费支持。
注:该课题组是世界上最早探索CRISPR基因编辑技术的几个实验室之一,曾于2013年初和2014年分别在国际遗传学经典期刊Genetics和G3·Genes|Genomes|Genetics连续发表了一系列方法学论文,引用达200多次;建立的基因编辑方法及相应的配套试剂已广泛被世界上很多实验室使用。作者曾出任2015年国际果蝇大会(美国)·果蝇生物技术与资源分会Co-Chair。实验室主要运用遗传学方法建立的动物模型,系统的研究染色质表观遗传因子(如非编码RNA及组蛋白修饰等)在发育与疾病方面的作用机制。研究成果多次发表在Nature、PNAS、Genetics、G3和EMBO J等国际学术期刊。
原文链接:http://genome.cshlp.org/content/26/9/1233.abstract
相关论文链接:
http://www.genetics.org/content/195/1/289.long
http://www.g3journal.org/content/4/5/925.long
http://www.g3journal.org/content/4/11/2167.long
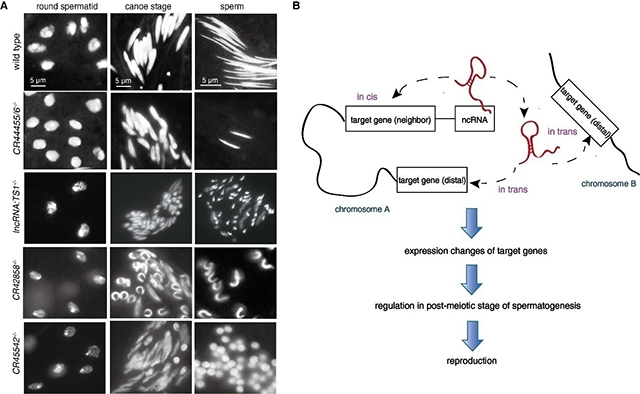
lncRNA突变导致精子发育异常及lncRNA可能的作用模型

