董忠军研究组揭示自然杀伤细胞活化和耐受调节新机制
清华大学医学院董忠军研究组
揭示自然杀伤细胞活化和耐受调节新机制
近日,清华大学免疫学研究所董忠军研究组与中国科技大学免疫学研究所田志刚研究组合作在《免疫》(“Immunity”)杂志在线发表题为《自身活化性 SLAM家族受体在NK细胞“教育”过程中发挥重要作用》(“The Self Specific Activation Receptor SLAM Family is Critical for NK Cell Education” )的研究论文,首次发现造血细胞特异性SLAM家族受体作为自身特异性活化型受体参与自然杀伤细胞活化和耐受的调节,这一发现揭示了一种新的NK细胞功能获得机制。这是继2012年董忠军研究组在Immunity上发表SAP蛋白调节NK细胞功能后又一重要发现。
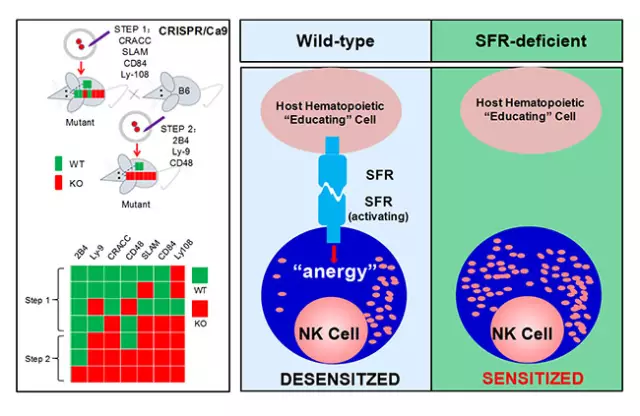
图一:制备SLAM家族受体联合敲除小鼠,发现自身活化性受体SLAM家族教育NK细胞
NK细胞是免疫系统第三大类淋巴细胞,主要负责免疫监视肿瘤和病毒感染细胞,其功能异常与肿瘤和慢性感染性疾病密切相关。随着NK细胞应用于肿瘤等疾病临床免疫治疗,NK细胞研究逐渐成为近年来的研究热点。免疫系统最显著的特点是具有区分自己(Self)和非己(Non-self)的能力。和获得性免疫(如T细胞和B细胞)不同,NK细胞属于非特异性固有免疫,不具有抗原特异性识别受体,因而不能通过抗原特异性的方式获得功能成熟(或称作Education)过程,也不能维持抗原特异性自身耐受。NK细胞如何完成“教育”过程,一方面获得杀伤功能,另一方面维持自身耐受,一直困扰着免疫学家。此前研究发现细胞表面广泛表达的自身主要组织相容性复合体(MHC)蛋白,可以结合一群MHC分子特异性的自身抑制性NK细胞受体,从而避免NK细胞对自身攻击。后来实验证明这群自身特异的抑制性受体可以“教育”NK细胞。
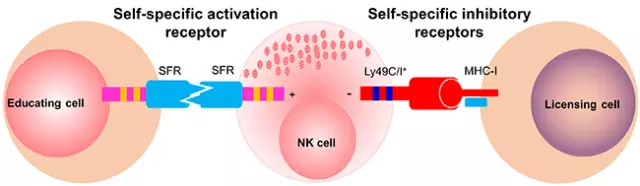
图二: 自身活化性和抑制性受体共同参与NK细胞“教育”
SAP基因缺失导致人类严重免疫缺陷性疾病X-连锁淋巴细胞增生综合症。董忠军课题组主要从事SAP的信号通路以及SAP上游SLAM家族受体研究,曾揭示SAP家族蛋白调节NK细胞攻击异基因骨髓细胞(Nature Immunology,2009),并阐明了其机制(Immunity,2012)。2013年初,该课题组采用CRISPR/Cas9基因组编辑技术,通过分布多点基因打靶,他们得到SLAM家族受体(共7个)和/或SAP家族蛋白(共3个)10基因敲除小鼠,因而解决了“SLAM家族受体冗余性”这一领域内公认的瓶颈问题。基于该模型,他们发现SLAM家族受体作为一群自身特异的活化性受体介导NK细胞对半同种异基因骨髓细胞的移植排斥;继而发现这群受体在NK细胞“教育”阶段持续性活化会导致NK细胞耐受(图一)。因此,不仅自身抑制性受体,他们首次实验证明NK细胞生理状态下存在的一群活化性受体可以“教育”NK细胞,并提出自身活化性受体和抑制性受体协同维持NK细胞耐受的新假说(图二)。
该课题是在国家自然科学基金委、国家科技部和清华大学-北京大学生命联合中心经费支持下完成。清华大学-北京大学生命科学联合中心四年级博士生陈莎莎同学(清华学籍)为论文第一作者,清华大学免疫学研究所董忠军研究员和中国科技大学生命学院田志刚教授为该文共同通讯作者,中国医学科学院动物研究所张连峰研究员和马元武副研究员参与了该项研究。
《免疫》(“Immunity”)是《细胞》(“Cell”)旗下免疫学子刊之一,杂志发表免疫学最重要的科研进展,最新JCR影响因子为24.082,在发表原著文章的140种免疫学杂志中,“Immunity”居第一位。


