王秀杰研究组在细胞类型特异的基因调控网络研究中取得进展
生物体内各种类型的细胞如何形成各自特异的调控网络进而获得特异的功能是生命科学研究中一个基础并且重要的问题。普遍的观点认为细胞类型特异表达的基因,尤其是转录因子,是形成细胞类型特异的调控网络的主要原因。但不同类型细胞间含有大量共同表达的基因,这些不同类型细胞中普遍表达的基因如何参与细胞类型特异的调控网络尚属未知。
为解决这一问题,王秀杰研究组与中国科学院动物研究所周琪课题组合作,通过系统比较小鼠胚胎干细胞(mESC)与多种体细胞的转录组数据,发现了104个可以利用mESC特异的选择性启动子调控其在mESC中表达的基因。这些基因在mESC和不同类型体细胞中均普遍表达,但在mESC中通过mESC特异的选择性启动子而产生mESC特异表达的新的转录本(SATS isoform)。这些SATS转录本通常与其对应基因的广谱表达的转录本(common isoform)在5'端的首个或首几个外显子存在序列差异,而其它序列相同。超过60%的SATS转录本具有与其对应的common转录本不同的读码框,部分来自表观遗传修饰和发育调控基因的SATS转录本发生了重要功能域的改变。mESC中表达的SATS转录本的转录大多受到多能性核心因子Oct4, Sox2 及Nanog的调控,功能研究表明SATS 转录本参与调控mESC多能性的维持,敲低部分SATS 转录本后导致mESC分化。这些结果表明细胞类型特异的转录因子可以通过调控选择性启动子,使得广谱表达的基因产生细胞类型特异的转录本,从而使广谱表达的基因获得参与建立或维持细胞类型特异特征的新功能。
该项研究成果于2016年7月27日在线发表于EMBO Reports 杂志(DOI: 10.15252/embr.201541476)上。王秀杰研究组已毕业的博士生冯桂海、助理研究员佟曼和周琪课题组的夏宝龙同学为该论文的共同第一作者,王秀杰研究员与周琪研究员为共同通讯作者。该项目得到国家重点基础研究发展计划(973计划)、中科院干细胞与再生医学战略性先导专项及国家自然科学基金等项目的资助。
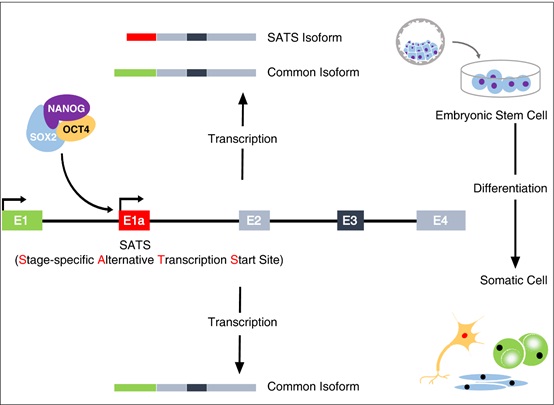
干细胞特异的转录因子通过选择性启动子调控广谱表达的基因产生
干细胞特异的转录本

