武汉植物园研究不同浓度CO2对龙舌草和海菜花CO2浓缩机制的影响
中国科学院武汉植物园水生植物生物学学科组硕士研究生张艺之在尹黎燕副研究员的指导下,研究高浓度和低浓度 CO2对水鳖科植物龙舌草和海菜花光合CO2浓缩机制的影响。相关研究成果已在植物学领域期刊《Photosynthesis Research》上发表。
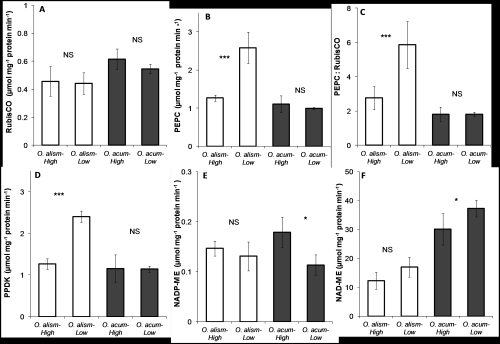
光合作用关键酶活性比较图
沉水植物缺乏功能性气孔,植物体-水体边界存在着阻隔气体扩散的静水层,水中自由CO2扩散缓慢,这些因素使水生植物普遍受到低浓度无机碳的胁迫。为获得无机碳,沉水植物在形态结构和生理生化上表现一定的特性,包括薄的叶片层以及对HCO3利用的能力,拟C4型和CAM型光合代谢途径的选择。沉水植物C4 和CAM光合代谢是沉水植物在环境胁迫下增加CO2浓度的一种适应,具有生理可塑性。
中国科学院武汉植物园水生植物生物学学科组硕士研究生张艺之在尹黎燕副研究员的指导下,利用pH-drift技术、Gran滴定、昼夜酸度滴定、光合关键酶活性的测定等方法,研究了高浓度(~400 µmol L-1)、低浓度(~5 µmol L-1) CO2对水鳖科植物龙舌草(Ottelia alismoides)和海菜花(Ottelia acuminata)光合CO2浓缩机制的影响。
结果表明:两种植物都具有利用水中HCO3-的能力,提取吸收水中无机碳的能力较强。龙舌草存在夜晚酸积累现象,昼夜∆H+为34μequiv g-1FW,可能存在景天酸代谢机制。不同处理后,海菜花的PEPC/Rubisco的值均为1.8,龙舌草高浓度处理后为2.8,低浓度处理后比值为5.9;PEPC、PPDK的活性增加约2倍;两种植物的脱羧酶NADP-ME活性都很低,而龙舌草的NAD-ME活性随着PEPC活性增加而增加。表明龙舌草尽管没有Kranz结构,但可能是NAD-ME亚型的C4植物。研究结果表明,水鳖科的海菜花和龙舌草有着不同的光合CO2浓缩机制来获取无机碳。
本文为水生植物中发现新的拟C4植物与CAM植物种类、阐明环境因子在水生植物无机碳利用策略选择中的作用、为高等植物C4与CAM光合途径的起源、进化及其生态学意义提供一定理论依据,为通过基因工程手段提高植物光合碳同化效率奠定基础。
本研究受到中国科学院外国专家特聘研究员计划(2010T2S14, 2013T1S0021) 和国家自然科学基金 (30700083)的资助。
尹黎燕
女,博士,副研究员,硕士生导师。1976年出生于浙江绍兴市嵊州;2005年获中国科学院水生生物研究所环境科学博士学位,并获优秀博士毕业生称号;2005年到中国科学院武汉植物园水生植物生物学实验室工作;主要从事植物逆境生理生态;水生植物光合作用;种子生理生态、水环境保护等方面的研究工作。
近期研究重点为长江中下游主要沉水植物无机碳利用策略、水生植物种子储藏与萌发机理、从氧自由基的角度探讨植物对逆境的响应机制与适应策略。主持国家科技支撑计划、IFS国际自然科学基金、国家自然科学基金等项目。已在国际国内刊物 (Environmental Science and Technology, Environmental Toxicology, Environmental Toxicology and Chemistry, Toxicon, Aquatic Botany, 中国环境科学,水生生物学报等) 上发表了30多篇相关的研究论文,其中SCI收录15篇,累计影响因子45.3,其中第一作者SCI收录论文8篇,累计影响因子24.1,所发表的第一作者学术论文经SCI、EI、CSSCI检索,单篇被其他人引用30次以上。
原文摘要:
Biochemical and biophysical CO2concentrating mechanisms in two species of freshwater macrophyte within the genus Ottelia (Hydrocharitaceae)
Yizhi Zhang, Liyan Yin, Hong-Sheng Jiang, Wei Li, Brigitte Gontero, Stephen C. Maberly
Two freshwater macrophytes, Ottelia alismoides and O. acuminata, were grown at low (mean 5 μmol L−1) and high (mean 400 μmol L−1) CO2 concentrations under natural conditions. The ratio of PEPC to RuBisCO activity was 1.8 in O. acuminata in both treatments. In O. alismoides, this ratio was 2.8 and 5.9 when grown at high and low CO2, respectively, as a result of a twofold increase in PEPC activity. The activity of PPDK was similar to, and changed with, PEPC (1.9-fold change). The activity of the decarboxylating NADP-malic enzyme (ME) was very low in both species, while NAD-ME activity was high and increased with PEPC activity in O. alismoides. These results suggest thatO. alismoides might perform a type of C4 metabolism with NAD-ME decarboxylation, despite lacking Kranz anatomy. The C4-activity was still present at high CO2 suggesting that it could be constitutive. O. alismoides at low CO2 showed diel acidity variation of up to 34 μequiv g−1 FW indicating that it may also operate a form of crassulacean acid metabolism (CAM). pH-drift experiments showed that both species were able to use bicarbonate. In O. acuminata, the kinetics of carbon uptake were altered by CO2 growth conditions, unlike in O. alismoides. Thus, the two species appear to regulate their carbon concentrating mechanisms differently in response to changing CO2. O. alismoides is potentially using three different concentrating mechanisms. The Hydrocharitaceae have many species with evidence for C4, CAM or some other metabolism involving organic acids, and are worthy of further study.

