上海设施核磁系统用户在HIV-1病毒包膜刺突蛋白质的跨膜区结构研究取得进展
上海设施核磁系统用户在HIV-1病毒包膜刺突蛋白质的跨膜区结构研究取得进展
——首次解析gp41跨膜区形成有序的三聚体结构,其对包膜刺突的膜锚定机理和Env结构稳定性起重要作用
北京时间6月24日,国际顶尖学术期刊《科学》Science在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所国家蛋白质科学中心(上海)周界文研究组与哈佛医学院Bing Chen博士研究团队的合作研究论文“Structural Basis for Membrane Anchoring of HIV-1 Envelope Spike”。该研究采用液体核磁共振技术首次揭示了HIV病毒包膜刺突(HIV-1 Envelope Spike)跨膜区域的精细三维结构。该研究首次在原子水平上展示了跨膜结构区域是如何锚定、稳定和调控HIV病毒包膜刺突三聚体的分子机理。为针对艾滋病病毒的疫苗设计提供新的思路。
人类免疫缺陷病毒(Human Immunodeficiency Virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,人类免疫缺陷病毒在法国和美国首次发现。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效预防方法,对人类健康造成极大威胁。
HIV-1包膜刺突(Envelope Spike,Env)是病毒粒子表面上的唯一抗原,是目前疫苗设计的唯一目标。 Env的作用是,通过与宿主细胞受体发生相互作用,帮助病毒进入细胞。成熟的Env,(gp120/gp41)3,是由三个gp120和三个gp41亚单元组成的三聚体。 其中gp41是跨膜蛋白,gp120位于表面,并与gp41通过非共价作用结合。近年来,关于这个包膜刺突的胞外区的结构信息有很多研究报道,但是关于跨膜区(TM)和它的膜近端区域(包括近外膜区域和胞质尾区),的结构机制还不是很清楚。
在周界文研究员的指导下,利用近期建立的一整套高效的膜蛋白核磁技术,并充分利用国家蛋白质科学研究(上海)设施和哈佛大学的高场核磁共振谱仪,该研究团队在类似磷脂膜的双分子环境中,首次解析了HIV-1包膜刺突跨膜区域和近膜端区域的高分辨空间结构。结果表明, 跨膜区域形成有序的三聚体结构,保护埋在膜内保守的精氨酸残基。N端卷曲螺旋和C-末端的亲水核心一起稳定这个三聚体,而后者可以在结构上联接到胞质区尾巴。个别保守残基的突变不能完全破坏TM三聚体,它们对膜融合和病毒的感染的影响非常小。但是,亲水核中的氨基酸突变,可以改变成熟Env对抗体的敏感性。该研究首次证实了跨膜区域形成的有序三聚体结构,不仅对Env的膜锚定和膜融合起关键作用,而且对于整个HIV包膜刺突的结构稳定性非常重要。
上海设施核磁系统的技术主管刘志军博士作为本项研究的合作者之一, 依托900兆高场核磁共振谱仪,有针对性地优化脉冲序列,采集了一整套高质量的核磁共振数据,为此项研究提供了强有力的专业技术服务。
上海设施核磁系统自2014年5月开放运行至今,已经为来自国内外14个单位的54个课题提供实验服务。 核磁系统技术团队陆续建立了一整套先进的脉冲序列和实验方法,应用在膜蛋白质结构与功能、蛋白质动力学与功能、蛋白质-配体的弱相互作用、RNA核磁实验和核磁方法学研究等多个领域。相关的用户合作课题在Nature、Science、Nature子刊、JACS、Structure和Scientific Report等国际著名期刊上发表,为各领域科学家的研究成果起到了有力的支撑促进作用。核磁系统目前正全面对外开放中。
该研究工作受到美国国立卫生研究院和中国科学院战略性先导科技专项(B类)的经费资助。(生化与细胞所)
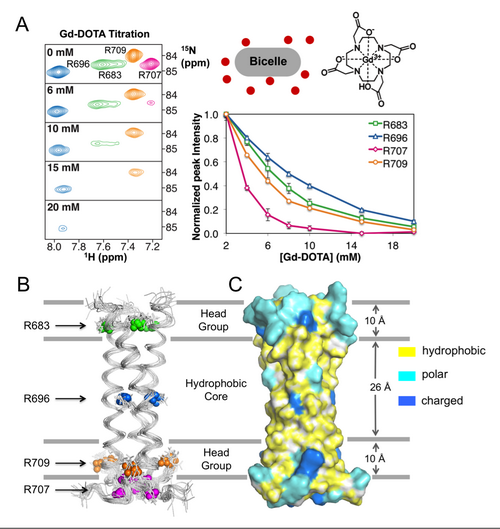
(A)利用液体核磁共振的顺磁探针Gd-DOTA, 测量四个精氨酸残基在细胞膜内的不同包埋深度。
(B) (C) HIV-1包膜刺突gp41跨膜区三聚体核磁结构示意图
相关附件
