科学家揭示炎性因子IL-17A调控甲状腺相关眼病发生发展新机制
5月25日,美国内分泌学会主办的学术期刊Journal of Clinical Endocrinology and Metabolism 在线发表了中国科学院上海巴斯德研究所李斌课题组与中国科学院上海生命科学研究院/上海交通大学医学院健康科学研究所范先群课题组的合作研究成果,揭示了炎性因子IL-17A调控甲状腺相关眼病(Thyroid-associated ophthalmopathy,TAO)发生发展的新机制。
TAO是累及眼眶及其周围组织的自身免疫性疾病,其发病率逐年上升,在成人眼眶病中居首位。该疾病临床表现为淋巴细胞过度浸润、脂肪异常增生和眼外肌纤维化变性,引起眼球突出、眼睑退缩、眼球运动障碍、斜视、复视,压迫性视神经病变、暴露性角膜炎,视力下降甚至失明等症状,严重危害患者的视功能和颅面外形,给家庭和社会造成沉重的负担。
上海交通大学医学院附属第九人民医院眼科博士研究生方思捷、硕士研究生黄雅琢,上海巴斯德所分子免疫学课题组、上海大学联合培养硕士研究生王帅威等在李斌、范先群、周慧芳的合作指导下,通过分析TAO患者外周血免疫细胞表型,发现患者体内增高的IL-17A来源于Th17细胞、Tc17细胞和部分γδ T细胞。在TAO患者眼眶组织内,IL-17A,IL-6,IL-23,IL-1β和TGF-β等炎性因子水平远远高于健康人群。进一步研究发现,IL-17A与TAO 患者眼眶成纤维细胞高表达的IL-17RA受体结合后,可以通过激活下游丝裂原活化蛋白激酶(MAPK)信号转导途径(包括ERK1/2、p38和JNK途径),促进眼眶成纤维细胞分泌炎症因子和趋化因子,同时促进细胞外基质大量合成,导致TAO自身免疫性病变及纤维化病理变性。结合课题组前期成果,研究人员利用来自树菇类莲座革菌的天然单分子产物组分Vialinin A,抑制RORγt的去泛素化酶USP4活性来下调细胞内RORγt蛋白水平,从而抑制TAO患者体外培养炎性Th17及Tc17细胞功能。该研究对控制炎症环境下Th17细胞炎性细胞因子IL-17A的过度产生具有重要的指导性意义及潜在临床应用价值,为TAO及相关自身免疫性疾病临床诊治提供了新靶点和理论基础。
该项研究获得科技部“973”项目、国家杰出青年基金、国家自然科学基金委面上及重点项目等经费支持。
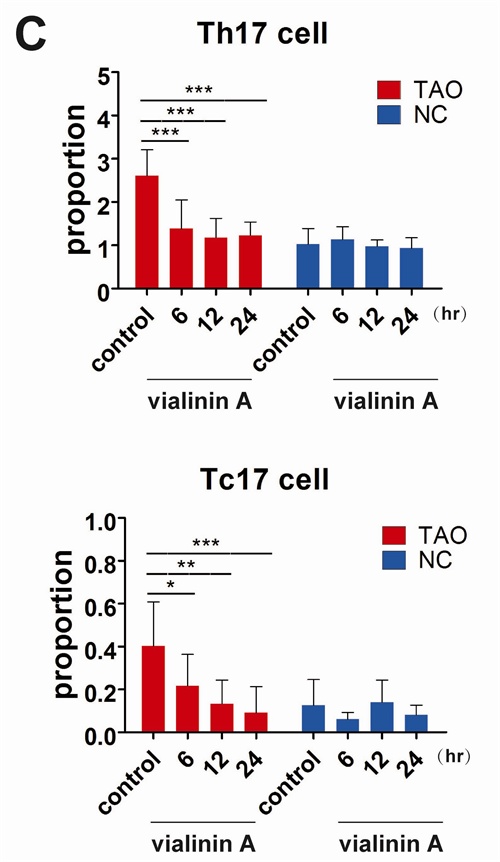
图示:来自树菇类莲座革菌的天然产物单分子组分Vialinin A,可以抑制甲状腺相关眼病患者Th17细胞及Tc17细胞中RORγt蛋白水平。

