国家蛋白质科学研究(上海)设施用户揭示细胞焦亡分子机理
6月9日,国家蛋白质科学研究(上海)设施五线六站用户北京生命科学研究所研究员邵峰及其合作者中国科学院生物物理研究所王大成组在《自然》(Nature)杂志在线发表题为Pore-forming activity and structural autoinhibition of the gasdermin family 的长文(article),揭示了GSDMD蛋白以及其它gasdermin家族蛋白介导细胞焦亡和在天然免疫中发挥功能的

细胞焦亡或炎性坏死是一种程序性细胞坏死,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。细胞焦亡是机体重要天然免疫反应,在拮抗感染和内源危险信号中发挥重要作用。过度的细胞焦亡会诱发包括败血症在内的多种炎症和免疫性疾病。传统研究认为,细胞焦亡由包括caspase-1和caspase-4/5/11在内的炎性caspase活化而诱发。Caspase-1在病原信号诱导形成的炎症小体复合物作用下被激活;实验室此前的工作表明caspase-4/5/11是细菌脂多糖(LPS,又称内毒素)的胞内受体,在结合LPS后发生寡聚而活化,是革兰氏阴性菌诱导败血症的关键因素(Shi et al., Nature 2014)。然而,20多年来人们对于炎性caspase如何诱导细胞焦亡的机理一直完全不清楚。在去年的一项突破性进展中,实验人员找到了一个所有炎性caspase的共同底物蛋白GSDMD,炎性caspase通过切割GSDMD释放其N端结构域而引发细胞焦亡(Shi et al., Nature 2015)。GSDMD属于一个被称为gasdermin的功能未知的蛋白家族,该家族还包括GSDMA,GSDMB,GSDMC,DFNA5,DFNB59等。人的DFNA5和小鼠Gsdma3的遗传突变分别导致非综合征性耳聋和小鼠脱毛以及皮肤发炎等疾病,GSDMB基因的多态性和儿童哮喘的发生密切相关。该研究也发现GSDMA3蛋白虽然不是炎性caspase的底物,但其N端结构域也能诱导细胞焦亡,并且,导致小鼠脱毛的突变体GSDMA3蛋白都丧失了分子内自抑制作用进而显示出持续诱导细胞焦亡的活性。然而,炎性caspase切割GSDMD如何引发细胞焦亡及其它gasdermin家族蛋白在细胞焦亡相关天然免疫中如何发挥功能的机制则仍然不清楚,这也是天然免疫研究的前沿热点问题。
在这项新的研究中,研究人员首先发现几乎所有的gasdermin家族蛋白的N端结构域都具有诱导细胞焦亡的功能,而除GSDMD外,其它家族成员并不是炎性caspase的底物,这个发现重新定义了细胞焦亡概念,开辟了一个新的程序性细胞坏死的研究领域。有意思的是,gasdermin家族的N端结构域在细菌中也显示出明显的致死毒性。这一现象暗示gasdermin N端结构域可能是通过直接破坏细胞膜而产生杀死细胞。为了验证这一假设,他们制备了活化形式的GSDMD,GSDMA 和 GSDMA3蛋白,在体外脂质体共沉淀的实验中,这三种gasdermin蛋白的N端结构域均能够特异地结合磷酸化磷脂酰肌醇(phosphoinositide)或心磷脂(cardiolipin),而4, 5-二磷酸磷脂酰肌醇和心磷脂分别是真核细胞和原核细胞膜上特有的磷脂,这和gasdermin N端结构域在真核细胞和细菌中均展示出细胞毒性完全吻合。通过生物化学和荧光显微成像的细胞实验,研究人员进一步证实,在真核细胞焦亡过程中,活化的gasdermin N端结构域会从细胞质中转移到细胞膜上,细胞随后出现体积膨胀和细胞膜向胞外吐泡的现象。此外,活化的gasdermin N端结构域重组蛋白只能从真核细胞内部破坏细胞膜,而直接加入到细胞培养上清中的蛋白则不能裂解细胞,这也和磷酸化磷脂酰肌醇只分布在细胞膜内侧完全吻合。
利用脂质体泄漏实验,研究团队进一步发现gasdermin N端结构域能够高效特异地破坏含有4, 5-二磷酸磷脂酰肌醇或心磷脂的脂质体,导致其发生严重泄漏,利用不同尺寸葡聚糖分子,他们发现破坏后的脂质体只能允许小于10纳米尺度的分子被释放,该现象提示gasdermin N端结构域有可能在脂膜上聚合形成规则的孔道。生化交联实验结果证实gasdermin N端结构域在结合脂质体或是在细胞焦亡中转位上膜后都会发生高度聚合。利用负染电镜的方法,他们首次观察到gasdermin N端结构域能在特异磷脂或天然磷脂组成的膜上打孔,形成很多蜂窝状的孔道,这些孔道的内径约10-14 纳米。进一步的电镜分析揭示这些分子孔道具有16重对称性,表明gasdermin N端结构域在膜上形成16元聚合体的孔道。此外,他们还通过对GSDMA3蛋白高分辨率晶体结构的解析,揭示了gasdermin N端结构域作为一种全新的打孔蛋白的独特结构特征,以及与C端结构域之间的精细的自抑制相互作用。基于结构设计的点突变实验结果进一步确认了gasdermin N端结构域结合膜脂和在膜上打孔的特性是其诱导细胞焦亡的分子基础。
该研究证明了GSDMD是炎性caspase诱导细胞焦亡的直接执行者,首次揭示了gasdermin 家族蛋白的N端结构域具有在膜上打孔进而破坏细胞膜的功能,这不仅清晰阐明了炎性caspase通过GSDMD诱导细胞焦亡的分子基础,也将细胞焦亡的概念重新定义为由gasdermin介导的细胞程序性坏死。研究结果不仅为针对GSDMD开发自身炎症性疾病和败血症的药物奠定了坚实的理论基础,也为后续研究其它gasdermin蛋白在程序性细胞坏死和天然免疫中可能的生理功能开辟了道路。
国家蛋白质科学研究(上海)设施五线六站(BL18U1/BL19U1)为该课题结构数据收集提供了支持,收到了高分率的硒带衍射数据,直接顺利解出了结构。线站工作人员积极参与,为晶体结构衍射数据收集提供了相应的专业技术支持,为该成果的发表做出了有力贡献。
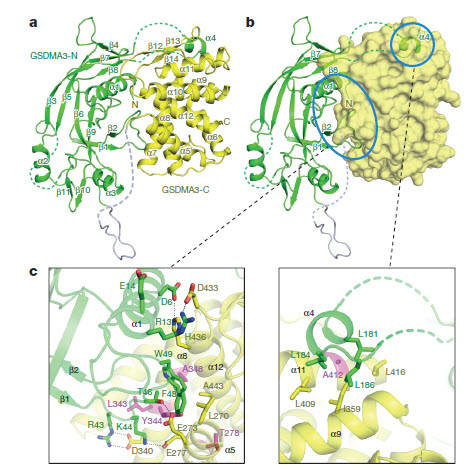
图示:GSDMA3的晶体结构以及Gasdermin家族蛋白分子内自抑制的结构基础

