Biomaterials:北大陈匡时课题组发表活细胞基因表达可视化研究成果
2016年5月24日,国际生物材料学国际顶级期刊《Biomaterials》杂志上在线发表了北京大学工学院生物医学工程系陈匡时课题组题为“Single-Molecule Detection and Tracking of RNA Transcripts in Living Cells Using Phosphorothioate-Optimized 2’-O-Methyl RNA molecular Beacons”的研究论文,论文报道研究人员研制出一种能在活细胞中检测单个RNA的分子探针。博士研究生赵丹为论文第一作者,工学院特聘研究员陈匡时为论文通讯作者。
完全阐明RNA分子在活细胞内的表达、转运和定位,以及它们与疾病发生发展的关系,至今仍然是一项挑战。MS2-GFP系统是目前在活细胞内检测单分子RNA的主要工具,对于研究细胞生理以及疾病的早期发生与发展机制具有重要意义。但该系统存在荧光弱、背景信号高以及分子量大的缺点,对进一步深入研究RNA在细胞中的功能、活性以及与其它大分子交互作用的贡献有限。另一种可标记RNA的技术——分子信标(molecular beacons, MB),是一种可形成茎环结构的寡核苷酸探针,具有能与目的RNA结合后茎结构解离并能释放荧光的特性。然而研究证实,普遍使用的MB(由DNA或是2'O-Methyl RNA即2Me组成)被导入细胞质后会迅速被细胞核吸收,并被核内的核酸酶降解,引起高达60%的假阳性信号,从而使细胞中的RNA无法被准确地检测。
通过优化MB寡合干酸的化学组成,陈匡时实验室成功研制出具有2Me以及phosphorothioate(PS)两种化学修饰的分子信标(2Me/PSLOOP MB)。该探针具有分子量小(10000Da)、稳定性高、高信号背景比、高准确性、无毒性以及不干扰基因表达等优点,在宽敞显微镜下可检测单一RNA在细胞核以及细胞质中的动态行为。新型分子信标技术的应用有望帮助研究者对目的RNA在不同细胞器的表达、转运以及定位进行更深入的阐述。
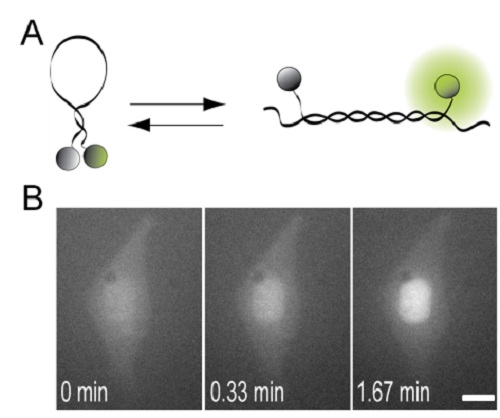
图:传统分子信标。 A:分子信标与目的RNA互补的前后变化。B:无义分子信标在进入细胞后迅速在细胞核中释放假阳性信号。
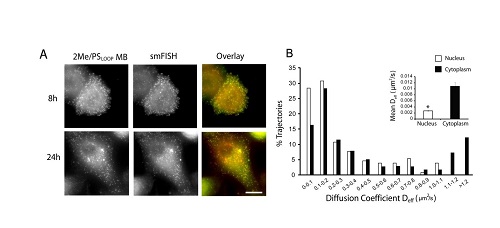
图:A:细胞中新型分子信标和原位杂交技术(smFISH)在不同时间点的RNA单分子成像比较。2B:分子信标在活细胞中的细胞核与细胞质单分子示踪mRNA
原文链接:
Single-Molecule Detection and Tracking of RNA Transcripts in Living Cells Using Phosphorothioate-optimized 2’-O-Methyl RNA Molecular Beacons
原文摘要:
Molecular Beacons (MBs) composed of 2′-O-methyl RNA (2Me) and phosphorothioate (PS) linkages throughout the backbone (2Me/PSFULL MBs) have enabled long-term imaging of RNA in living cells, but excess PS modification can induce nonspecific binding, causing false-positive signals. In this study, we evaluate the intracellular stability of MBs composed of 2Me with various PS modifications, and found that false-positive signals could be reduced to marginal levels when the MBs possess a fully PS-modified loop domain and a phosphodiester stem (2Me/PSLOOP MB). Additionally, 2Me/PSLOOP MBs exhibited uncompromised hybridization kinetics, prolonged functionality and >88% detection accuracy for single RNA transcripts, and could do so without interfering with gene expression or cell growth. Finally, 2Me/PSLOOP MBs could image the dynamics of single mRNA transcripts in the nucleus and the cytoplasm simultaneously, regardless of whether the MBs targeted the 5’- or the 3′-UTR. Together, these findings demonstrate the effectiveness of loop-domain PS modification in reducing nonspecific signals and the potential for sensitive and accurate imaging of individual RNAs at the single-molecule level. With the growing interest in the role of RNA localization and dynamics in health and disease, 2Me/PSLOOP MBs could enable new discoveries in RNA research.
doi:10.1016/j.biomaterials.2016.05.022
作者:陈匡时

