肠道菌群 | Science专刊:决定你健康状况的"第二基因组"
肠道菌群与人体健康密切相关,二者之间的关系是目前研究的热点。随着研究者的不断深入,我们发现,对人体微生物的了解还远远不够,它们能帮助我们做什么,以及我们如何改变它们?
4
月29日,美国《科学》杂志以“Microbiota at
work”为主题发了一期专刊,从不同的方面介绍了人体微生物与健康的关系,并且分析了饮食、药物、抗生素,益生菌和粪菌移植对肠道微生物的不同影响。这
些文章进一步让我们不仅能够了解微生物与人体的相互影响,还能知道人类是如何改变人体微生物的以及这些改变所带来的深远影响。
肠道中必不可少的共生微生物
人类其实并不孤单,包括人类在内的所有生物,都生活在微生物的海洋中,例如人与庞大微生物群形成寄生和共生关系。少数种类的微生物(主要是各种病原菌)对
人类危害很大,但绝大多数微生物对人类健康来说是有益的,有些甚至必不可少。事实上,植物和动物的正常发育都离不开微生物的定殖,并且这种共生关系可能在
生命起源的那一刻起就建立了。
人类自身的基因可选择性地让共生微生物参与免疫调节,帮助人体建立防御屏障。这些分布于粘膜组织的微生物,在宿主出生后的免疫系统发育过程中起到了举足轻
重的作用。因此,生命早期微生物的定殖对人类健康可能有长期的影响,特别是对过敏和自身免疫等炎症性疾病的敏感性,具有重要而深远的影响。
然而,要想保持人体微生物的健康可不是一件容易的事。饮食、药物和严重的疾病等都可以破坏微生物。目前,我们对人体微生物的认识还非常有限,对它的影响因素和影响机制知之甚少。
虽然如此,随着越来越多的研究出现,对人类有保护作用的共生微生物的菌株在不断增加,这其中蕴藏着巨大的商业价值和开发前景。不可否认的是,益生菌已经在
重建和恢复一些人的健康肠道微生物方面,显示出了巨大的潜力。然而,益生菌产业也面临着巨大的挑战,一些企业肆无忌惮地夸大益生菌的健康作用,在现有的监
管框架下,制定严格的测试标准仍存在困难。
宿主基因可调控特定种类的肠道菌群
为什么不同人的肠道微生物有差异?除了饮食习惯和生活环境外,不同人的基因构成也会影响肠道微生物组成。Julia
Goodrich和其同事的综述文章,给我们介绍了宿主基因和肠道微生物之间的关系,以往的研究表明,肠道中某些类型的微生物受到人类基因的影响,如在双
生子研究中,同卵双胞胎肠道微生物的相似性要比异卵双胞胎的相似性更高。研究者还发现厚壁菌门的Christensenellaceae科细菌和一些产甲
烷的史氏甲烷短杆菌(Methanobrevibacter smithii)有很强的遗传性,与同卵双胞胎相比,异卵双胞胎有更多的史氏甲烷短杆菌。
在为数不多的全基因组关联分析(GWAS)结合肠道微生物研究中,特定种类的肠道微生物丰度受宿主基因型调控,且绝大多数可遗传的肠道微生物属厚壁菌门, 而拟杆菌门大多是不可遗传的。相比人类,小鼠的肠道微生物的遗传能力要高于其它物种,这可能与环境有关,小鼠饲养的环境通常是可控的,因此小鼠是研究微生 物与基因互作非常好的模型。
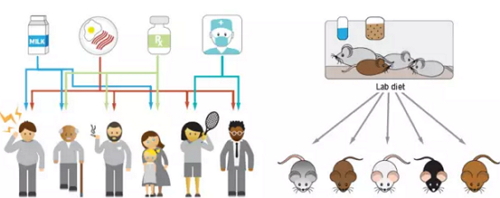
环境因素影响肠道菌群以及小鼠模型,图片来自Science, (Goodrich et al., 2016)
此 外,全基因组分析和肠道微生物的研究发现,双歧杆菌属(Bifidobacterium)的相对含量与乳糖分解酶基因(LCT)的基因位点相关。具有乳糖 分解酶的个体喝下牛奶后,其产生的酶会分解牛奶中的乳糖,而没有乳糖分解酶的个体喝下牛奶后,肠道中的双歧杆菌会帮助分解乳糖,并可导致其体内双歧杆菌的 数量相对增多。然而,在不喝牛奶的人体中,无论是否携带有乳糖分解酶基因,他们之间的双歧杆菌相对数量差别不大。
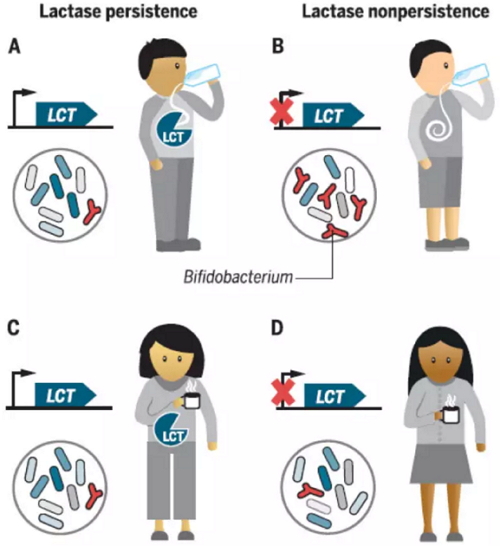
乳糖耐受与双歧杆菌,图片来自Science(Goodrich et al., 2016)
另外,通过对欧洲哈特派信徒(Hutterites)研究发现,双歧杆菌属的富集与嗅觉受体相关的基因关系密切,而梭菌科的细菌富集与免疫过程相关的基因关系密切。这说明肠道微生物的丰度确实受宿主的基因调控,且这种类似的现象,在果蝇和植物中也被发现。
尽管已知肠道微生物与宿主的食物分解、代谢和免疫相关的基因存在密切联系,然而我们仍不清楚宿主和微生物之间的共进化关系。未来将会有越来越多的全基因组研究出现,更大规模的样本量和对微生物表型定量描述的方法越多,将有助于我们揭开微生物和宿主之间的关系。
重塑肠道微生物可对抗病原菌感染
肠道微生物在对抗病原菌感染方面发挥了重要作用。抗生素在发挥抗感染作用的同时,也在破坏肠道微生物的屏障作用。Eric Pamer等人的文章,不仅分析了肠道微生物抗感染的作用,还讨论了抗生素治疗引起的不良后果以及如何采用益生菌来修复肠道微生物。
丰
富的肠道共生微生物能协助宿主抵抗多种病原菌的侵袭。这些共生微生物通过产生防御素、短链脂肪酸和胆汁酸盐等物质刺激免疫激活,产生的代谢物质间接帮助宿
主抵御肠球菌、李斯特菌、艰难梭菌和大肠杆菌的感染。它们还能通过自身产生的营养物质和细菌素等防御物质直接作用于病原菌,帮助宿主抵御沙门氏菌和拟杆菌
的感染。
当人们受到病原菌感染时,通常会用抗生素来治疗。事实上,抗生素并不能“精准”地杀死病原菌,抗生素在抑制病原菌的同时,不仅会杀死某些肠道共生微生物,
同时也会促进一些对抗生素有抵抗力的肠道微生物(耐药菌)的生长。合理地使用抗生素,能减少超广谱β-内酰胺酶产生型肠杆菌、碳青霉烯抗性肠杆菌、万古霉
素抗性肠球菌和艰难梭菌等耐药菌的产生。从某些方面来说,抗生素的使用反而会使人更易感染病原菌。重新建立“好的”微生物可帮助修复这一问题。这些“好
的”微生物通常指益生菌,它们可以帮助宿主重塑肠道微生物。
自从1908年的诺贝尔奖得主伊利亚·梅奇尼可夫(Ilya
Metchnikov)发现乳酸菌对人健康长寿的重要作用以来,越来越多的益生菌用于重塑人体健康的肠道微生物。最新研究表明,双歧杆菌有助于促进肿瘤免
疫疗法的效果。目前,益生菌已在全球范围内成为一项每年销售额达三千亿美元的大生意。然而,由于缺乏深入的临床研究,市场上大量的益生菌并不具有特定的疗
效。尽管越来越多的研究表明,益生菌在帮助重建和增强肠道菌群抵抗力方面发挥重要作用。益生菌在减少医疗过程中引起的感染方面具有重要价值。在益生菌制剂
研发过程中,需要加强益生菌制剂的生产、包装、运输、剂型、安全性、有效性和临床效果方面的研究。益生菌制剂的商业开发、专利保护和临床应用以及最终获得
FDA的批准,仍有很长的路要走。
幼年:人体微生物的关键“窗口期”
人体微生物对健康至关重要,而幼年期微生物的定殖更为关键。这一时期微生物在粘膜组织的定殖可对免疫系统进行培育,这对人体健康和疾病方面具有关键作用,
这一时期就是微生物定殖的“窗口期”。Thomas
Gensollen及其同事的综述表明,婴儿期微生物的定殖会影响哺乳动物免疫系统的发育,并且这种影响一直持续到成年。对完全清除微生物的无菌小鼠研究
发现,其肺部和结肠部位往往有较高水平的自然杀伤(NK)T细胞,这会增加其对结肠炎的易感性。
类似的情况也发生在免疫系统和皮肤发育上。无菌小鼠的血清中免疫球蛋白E(IgE)过量会出现过敏反应,如果在无菌小鼠生命的前4周内,人为地定殖某些微
生物,可保持IgE的正常分泌,但是4周之后再定植这些微生物基本没有作用的,研究还发现定殖时,微生物的丰度不够也达不到目的。
此外,在出生之后,两周内暴露于特定的共生微生物抗原,能够激活免疫细胞Treg细胞活性,使其在成年后识别特定的共生微生物抗原,从而不产生免疫排斥反应;如果两周之后暴露于特定的共生微生物抗原,就没有上述作用。
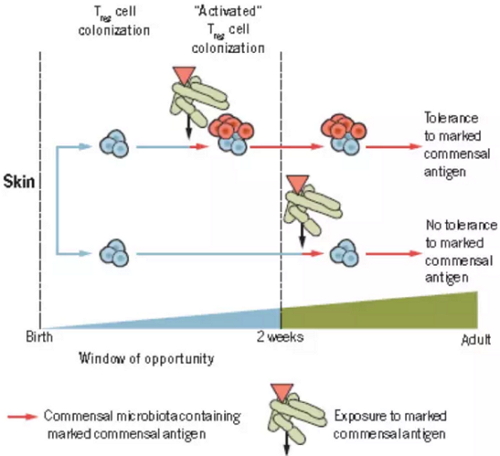
出生小鼠皮肤上T细胞的定殖,图片来自Science(Gensollen et al., 2016)
粘膜系统是人体与微生物交流最密切的部位,幼年时期微生物在粘膜系统的正常定殖对人体的健康与疾病均具重要作用。破坏人和共生微生物间的和谐关系,会对免疫系统产生不可逆的影响。微生物的“窗口期”对人的健康具有长期影响,能够影响成年后过敏、哮喘和对周围环境的耐受。
让人又爱又恨的抗生素是把双刃剑
随着人体微生物研究的发展,越来越多的研究表明,抗生素对人体微生物,特别是对肠道微生物影响深远。抗生素是一类特殊的药物,能够抑制和杀死多种致病菌。
早期抗生素挽救了无数人的生命,不仅治疗了个体的感染,还阻止了疾病在人群中传播,让更多的人活了下来。这就是抗生素的两个优点:对抗细菌的感染及防止病
原菌在人群和环境中扩散。然而正如青霉素的发明者亚历山大·弗莱明(Alexander
Fleming)在1945年获得诺贝尔奖时所说的那样,抗生素在临床应用过程中会产生耐药性。经过几十年的应用,我们已经为此付出了惨重的代价,虽然公
众和医生已经意识到抗生素的副作用,但对患者来说,他们更关注疗效,抗生素可能造成的危害以及耐药性问题却被忽视了。
日常生活中,抗生素滥用的现象比比皆是。父母在为生病的孩子求医时,一般只会考虑考虑药物的安全性和有效性,而不会顾及药物使用对人类健康的整体影
响。此外,更严重的是,农民们在动物养殖中大量使用抗生素,减少家畜疾病发生,也增加了产量,他们从中获得经济收益,但他们滥用抗生素,根本不会考虑抗生
素对环境人类的长远影响。
抗生素对儿童的影响深远。通过对儿童临床和流行病学研究和观察,越来越多的证据表明,抗生素暴露会使他们患上包括肥胖、I型和II型糖尿病、炎症性肠道疾
病、腹腔疾病、过敏和哮喘等疾病的风险增加。动物模型研究表明,抗生素对这些疾病的影响不是简单的相关性,而是因果关系。在对小鼠的研究时发现,抗生素会
破坏微生物的发育,导致菌群多样性丧失,最终可致肥胖和代谢紊乱,影响骨骼生长和正常的免疫发育。
直到近些年,人们才意识到,抗生素的使用对人体内正常肠道微生物会有负面影响,进而威胁人体健康。这就是抗生素的两个缺点:引起细菌耐药性和影响正常
的人体微生物。直到近几年,抗生素对人体微生物的影响才受关注。特刊中Martin
Blaser撰写的这篇文章,分析了不同国家人口微生物多样性的变化,发现美国人肠道微生物的减少与早期卫生设施的引进,包括过滤和氯化饮用水以及早期使
用抗生素存在密切联系。随着饮食的现代化,发展中国家人们的微生物多样性正在急速减少,并且呈现出微生物多样性减少的间隔时间缩短,变化不规则等特点。
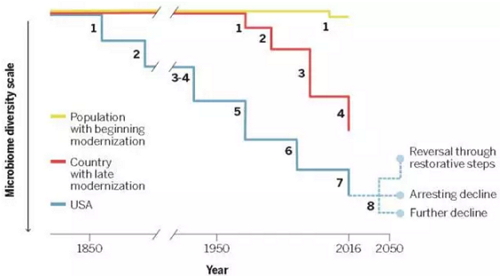
不同社会群体肠道微生物多样性随时间梯度的改变,图片来自Science(Blaser, 2016)
文章还讨论了抗生素使用对人体微生物产生的后果,并提出了未来抗生素使用和研究的方向,开发针对特定病原体更具针对性的窄谱抗生素,从而最大限度地减少对人体共生微生物的伤害,保护健康人体微生物的结构和功能。
解读健康人的肠道微生物信息
Falony等人发表在《科学》的这项研究,是迄今为止最大规模的健康人肠道微生物的解读文章。文章整理了1106个比利时人,1135个荷兰人以及其它
数据库,共计3948个健康人的肠道微生物、生理以及其他基本信息。分析结果表明,在这些健康人中共发现了664个属的微生物,其中14个属的微生物可作
为核心肠道微生物,它们存在于95%的人肠道中,主要发生变化的菌是Ruminococcaceae
、Bacteroides和Prevotella,而这些细菌正是组成肠型的三种菌。
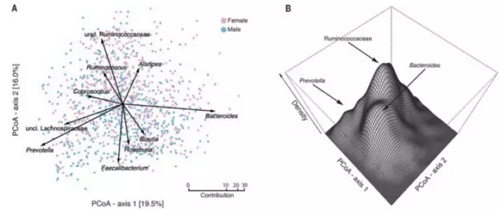
肠道菌群中物种的差异,图片来自Science(Falony et al., 2016)
在
503个不同的临床和问卷调研项目中,有69项与肠道微生物关系密切,特别是与微生物多样性密切相关。其中大便形状(依据布里斯托粪便量
表,Bristol stool score)与微生物组成相关度最强。其它因素还包括红细胞数量,尿酸含量以及年龄等,都与微生物组成密切相关。
研究还发现,药物是解释微生物组成变化的最主要因素,其次是血液参数、排便习惯、健康状况、人体测量指标和生活方式,它们可解释16.4%的肠道微生
物组成变化。为了找到非冗余的,能够解释肠道微生物组成变化的变量,研究者找到了18个变量,解释了7.63%的变化。粪便性状仍然是最主要的因素。
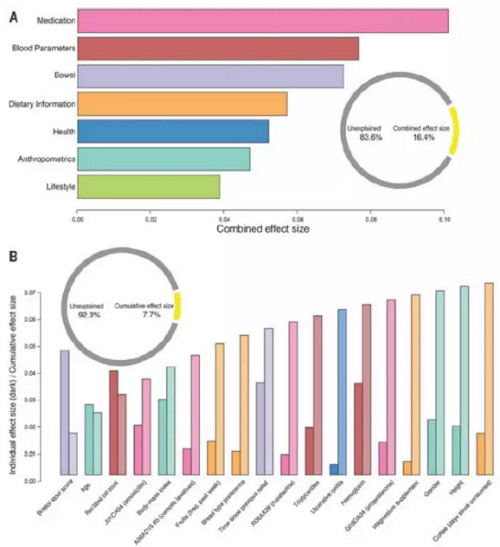
影响肠道菌群多样性的不同变量,图片来自Science(Falony et al., 2016)
研
究者进一步分析大便形状和肠道微生物组成的关系,发现大便形状与肠道微生物的丰度、普氏菌型肠型以及Akkermansia
和Methanobrevibacter菌的丰度密切相关。进一步发现可知,Akkermansia菌的丰度与先前的恢复情况呈正相关,但它与胰岛素抵
抗,如体重指数和血液中的甘油三酯浓度呈负相关。而Faecalibacterium菌的数量依赖红细胞的数量,溃疡性结肠炎患者
Faecalibacterium菌的丰度降低。梭形杆菌属(Fusobacterium)没有与本研究中的任何非冗余变量相关,这可能表明这种菌与结直
肠癌存在特异相关性。
在本研究中,对微生物变化影响最显著的因子是药物使用,研究发现了13种主要药物,包括抗生素、渗透性泻药、炎性肠病用药、雌性激素、抗抑郁药和抗组胺药
等。其中唯一与属水平的肠道微生物呈显著相关的药物是内酰胺类抗生素(β-lactam
antibiotics)。肠道微生物与药物的交互分析表明,63%的肠道微生物的交互由药物驱动的,这显示药物对肠道微生物的巨大作用。令人意外的是,
一些被认为会影响成年人微生物组成的生命早期事件,如出生方式(剖腹产或顺产)及婴儿营养(母乳喂养)等因素,与微生物组成变异间没发现有相关性。
肠道微生物的生物标志物
在一项针对荷兰人的研究中,Alexandra
Zhernakova等人发现了一种关键蛋白,可作为肠道健康的生物标志物。通过对1135名荷兰人的菌群数据、饮食以及健康状况数据进行分析,研究者发
现了126个能够影响肠道微生物组成的因素,其中包括31项内在因素、12种疾病、19种药物、4种与吸烟相关因素以及60个与饮食相关的因素。
在内在因素中,研究者发现一种关键蛋白——嗜铬粒蛋白A(Chromogranin
A,CgA),它具有成为肠道健康生物标记的潜力,与饮食相关的总碳水化合物数量、植物性蛋白的量以及肠道微生物组成密切相关。CgA是一种在压力下或肠
道相关疾病如肠应激综合征、炎症肠道疾病等发病时,由神经、内分泌和免疫细胞分泌的多肽类物质。CgA在不同人的肠道微生物组成不同,其与61种肠道微生
物相关。肠道微生物多样性越高,CgA浓度越低。
此外,他们分析了多种饮食与肠道微生物的相关性,发现脱脂乳与较高的微生物多样性相关,而全脂乳与较低的微生物多样性相关;总碳水化合物摄入量与双歧杆菌
含量呈正相关,但与乳酸菌、链球菌和Roseburia菌呈负相关。而典型的西式饮食——如摄入较高的总能量、吃零食、喝高脂奶以及进食较高含量的碳水化
合物等与低丰度的微生物群落相关。研究还发现,喝加糖苏打饮料会降低微生物多样性,而喝咖啡、茶和红酒则会增加微生物多样性。
研究证实,使用抗生素可能会造成双歧杆菌的减少。药物的使用,如质子泵抑制剂(PPIs)、二甲双胍、他汀类药物及泻药等都会对肠道微生物产生重大影响。
这项研究同时也调查了吸烟状况:吸烟史、父母吸烟与怀孕期间吸烟等因素,与肠道微生物组成之间的关系,但相关性并不强。Eggerthella
和Coprobacillus属细菌分别与药物和食物过敏相关。值得注意的是,即使是心脏病发作也可能改变肠道微生物组成,心肌梗塞患者的肠道中,挑剔真
杆菌(Eubacterium eligens)丰度显著降低。
粪菌移植后的肠道微生物变化
粪菌移植能够治疗多种疾病,然而人们对移植后,供体菌群和受体菌群的相对变化知之甚少。Simone
Li等人的研究,采用宏基因组学方法跟踪了移植前后肠道菌群的动态变化。研究发现,相比对照组,进行粪菌移植的个体肠道微生物组成变化明显,多样性有所增
加,大部分肠道微生物是供体和受体共有的细菌,在移植前后约有20%的菌在种水平会发生变化。在供者特异性微生物种中,有相当部分在移植后长达3个月中仍
然存在。
具体到哪些菌在移植前后发生了变化以及供体和受体菌如何相互影响。研究发现,约有39 ±
23%的菌表现出对引入菌株的抗性,供体和受体共存的菌的比例约为44 ±
14%。供体菌株在受体中的持久性差异很大,有些能够持续存在并替换受体菌株,而有些则很快被消灭。
粪菌移植在消化道疾病中有显著疗效,对粪便移植后发生的微生物动态变化进行跟踪有助于进一步应用粪菌移植。可喜的是,移植后供体的菌群与受体能友好共
生,特别是当供体-受体菌株为同种菌时。但值得注意的是,不同人之间其供体-受体菌株的共生程度存在较大差异,因此,需要详细评估不同的人在接受粪菌移植
后菌株水平的变化。

